Persiguiendo el fluido eléctrico: cómo los científicos descubrieron el electrón
La celebración de 2025 como Año Internacional de la Ciencia y la Tecnología Cuánticas no podría llevarse a cabo sin echar un vistazo a cómo el portador de la electricidad reveló finalmente sus secretos, allanando el camino a la era cuántica.
Manténgase informado
Suscríbase al boletín de noticias de Knowable en español
Es bastante difícil imaginar un mundo sin electrones. Sin electrones, no habría televisión, radio ni internet. Ni teléfonos inteligentes, ni computadoras, ni electricidad. Por no hablar de los productos químicos, los alimentos y la vida. No habría átomos.
Por supuesto, los electrones siempre han existido en abundancia. Han estado presentes en el universo desde los primeros instantes después del big bang. Pero, a pesar de su ubicuidad, ningún ser humano supo gran cosa de ellos hasta casi el siglo XX. Hasta entonces, solo existían las más vagas pistas sobre las causas de las curiosidades de la electricidad estática y las corrientes eléctricas.
La búsqueda de esas pistas avanzó lentamente durante siglos. Pero una vez capturada la presa y determinada su identidad, el electrón hizo posible la magia de la tecnología moderna y dio origen a nuevos campos de la ciencia. Fue el electrón el que condujo a los científicos al extraño mundo de la mecánica cuántica, que este año celebra su centenario. El conocimiento del comportamiento del electrón y de sus poderes cuánticos transformó la civilización de formas que desafiaban todo lo que los antiguos hubieran podido imaginar.
Los antiguos filósofos griegos intuían que algo misterioso ocurría en las interacciones de la materia. Era bien sabido que el ámbar frotado con seda o piel adquiría la capacidad de atraer objetos pequeños y ligeros —un ejemplo de lo que hoy se conoce como electricidad estática—. Tales de Mileto, activo en torno al año 600 a.C., llegó a especular que el poder del ámbar y la atracción del hierro por la magnetita mineral tenían algo en común.

En la Antigüedad, los humanos descubrieron que el ámbar frotado con un paño adquiría el poder de atraer objetos pequeños y ligeros, pero la razón de este poder —la electricidad estática— permaneció misteriosa durante milenios.
CRÉDITO: NTV / SHUTTERSTOCK
Los avances durante la Antigüedad y la Edad Media fueron limitados. Pero a finales del siglo XVI, en Inglaterra, el médico de la reina Isabel, William Gilbert, observó que muchas sustancias, incluidas las varillas de vidrio, adquirían poderes de atracción similares a los del ámbar cuando se frotaban con seda. Gilbert se refería a estas varillas como “cuerpos eléctricos” o “eléctricos”, de elektron, la palabra griega para ámbar.
La búsqueda más profunda de los misterios de la electricidad llegó a mediados del siglo XVIII de la mano de Benjamin Franklin. Famoso por demostrar que el rayo es una forma de electricidad, Franklin también adujo en los conceptos básicos y proporcionó gran parte de la terminología para la futura investigación en ciencias eléctricas.
“Introdujo en el lenguaje del discurso científico relacionado con la electricidad palabras técnicas como más y menos, positivo y negativo, carga y batería”, escribió el historiador de la ciencia I.B. Cohen.
Franklin creía en un fluido eléctrico único —o “fuego eléctrico”— que existía independientemente de otras sustancias materiales. El vidrio frotado con las manos humanas, por ejemplo, no creaba fuego eléctrico, sino que trozos de fuego eléctrico preexistente se transferían de las manos al vidrio durante el frotamiento. El vidrio, en otras palabras, adquirió lo que Franklin denominó una carga eléctrica positiva; el déficit de fuego eléctrico de la seda lo dejó con una carga negativa.
El fuego eléctrico adquirido por el vidrio resultó no ser otra cosa que electrones. (Por desgracia, las convenciones terminológicas posteriores obligaron a asignar a los electrones una carga negativa. Pero eso no fue culpa de Franklin).
Franklin conjeturó que su fuego eléctrico, o fluido, “consiste en partículas extremadamente sutiles” que “pueden impregnar la materia común” con facilidad. Si alguien dudaba de la capacidad del fuego eléctrico para atravesar los cuerpos, Franklin comentaba que “una descarga de un gran tarro de cristal electrificado... probablemente le convencería”.

En el siglo XVIII, Benjamin Franklin realizó una serie de experimentos eléctricos que le llevaron a deducir que algún tipo de “fluido eléctrico” podía transferirse de un objeto a otro. Ese fluido resultó estar compuesto por lo que los científicos saben ahora que son electrones.
CRÉDITO: SCIENCE HISTORY IMAGES / ALAMY STOCK PHOTO
La investigación eléctrica floreció en el siglo XIX, lo que llevó a la comprensión de la relación mutua entre electricidad y magnetismo, manifestada en las ondas electromagnéticas que más tarde harían posible la radio, la televisión y el Wi-Fi. Pero la naturaleza del fuego eléctrico de Franklin permaneció oscura.
El descubrimiento de que un tubo de vidrio que contenía un gas a baja presión podía conducir la corriente eléctrica constituyó un avance fundamental. Cuando los cables de una batería se conectaban a los electrodos sellados dentro de cada extremo del tubo, aparecía un resplandor verde que emanaba del electrodo negativo. Como el electrodo negativo se denominaba cátodo, el resplandor verde pasó a conocerse como rayos catódicos.
Los experimentos del físico británico William Crookes demostraron que los rayos catódicos se desplazaban en línea recta, lo que sugería que eran una forma de luz. Pero Crookes demostró entonces que un imán desviaba la trayectoria de los rayos, descartando la luz. A partir de entonces, los principales físicos europeos debatieron si los rayos eran ondas o pequeñas partículas.
Al acercarse el final del siglo XIX, el debate sobre los rayos catódicos se fusionó con otras dos cuestiones eléctricas: si existía una unidad fundamental de carga eléctrica y, en caso afirmativo, si existía una partícula portadora de esa carga —una partícula fundamental más pequeña que un átomo—.
El físico británico J.J. Thomson fue uno de los primeros en investigar estas cuestiones. Thomson se formó como matemático, pero se dedicó a la física en el famoso Laboratorio Cavendish de Cambridge, trabajando a las órdenes del estimado Lord Rayleigh. En 1884, Thomson sucedió a Rayleigh como profesor titular del Cavendish.
En 1897 Thomson demostró que la carga eléctrica de los rayos catódicos estaba asociada a una masa definida, estableciendo que el electrón era una partícula. La relación entre esta masa y la carga eléctrica indicaba que la unidad de carga —el átomo de electricidad— era transportada por una masa inferior a una milésima de la masa del átomo de hidrógeno.
“La suposición de un estado de la materia más finamente subdividido que el átomo de un elemento es algo sorprendente”, admitió Thomson al anunciar sus descubrimientos en una conferencia en la Royal Institution. Sin embargo, eso era exactamente lo que había demostrado su experimento.
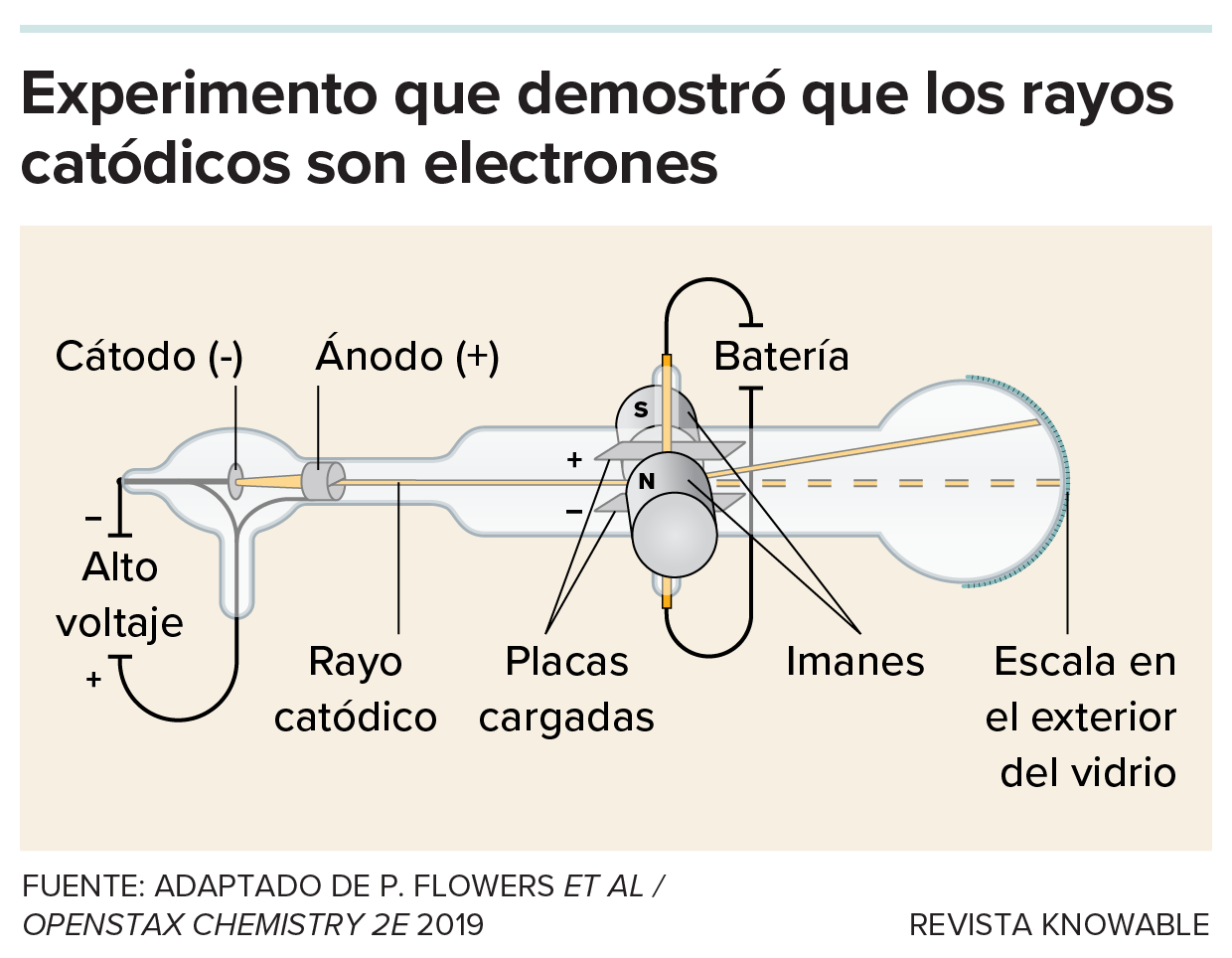
En 1897, J.J. Thomson sometió los rayos catódicos (producidos en un tubo de rayos catódicos) a campos eléctricos y magnéticos. Analizando la respuesta a esos campos, Thomson demostró que lo que llevaba la carga tenía una masa específica, independientemente del elemento utilizado en el tubo. Dedujo que los rayos catódicos estaban formados por pequeñas partículas cargadas eléctricamente a las que llamó corpúsculos, hoy conocidos como electrones.
Además, Thomson demostró que esta partícula tenía la misma masa independientemente del gas utilizado en el tubo y del elemento del que estuviera hecho el cátodo.
“Después de eso, ninguna persona razonable podía negarse realmente a creer que existían partículas más pequeñas que los átomos, o más ligeras que los átomos al menos, y que estas partículas desempeñaban un papel fundamental en la constitución de la materia”, escribió el hijo de J.J., George.
De ahí que Thomson (el padre) se atribuyera el descubrimiento del electrón, la primera partícula subatómica identificada. Llamó a su descubrimiento “corpúsculos”.
Pero curiosamente, la partícula ya había sido bautizada como electrón en 1891, años antes de su descubrimiento, por el físico irlandés George Johnstone Stoney. Stoney acuñó el término (de la palabra griega para ámbar, recordemos) para referirse a la unidad fundamental de la electricidad, aunque nadie sabía aún qué era. Poco después de que Thomson identificara la partícula, electrón se convirtió en el término popular.
Dentro del átomo
Poco después del descubrimiento de los rayos X y la radiactividad, la llegada del electrón aceleró aún más los frenéticos esfuerzos por averiguar qué ocurría en el interior de los átomos.
Un problema particular era cómo los átomos, conocidos por ser eléctricamente neutros en circunstancias ordinarias, podían contener partículas cargadas. Para compensar la carga negativa del electrón, el átomo debía contener algún tipo de carga eléctrica positiva. Pero nadie conocía la arquitectura adecuada que permitiera tal cohabitación.
Thomson propuso que los electrones cargados negativamente se incrustaban en un pudín de carga positiva, haciendo los electrones el papel de ciruelas. Sin embargo, no existían pruebas de tal disposición, y toda la idea se vino abajo en 1911, cuando Ernest Rutherford anunció el descubrimiento del núcleo atómico. Cada átomo contenía un núcleo diminuto, como el escenario de un teatro redondo con carga positiva, y los electrones con carga negativa relegados a los asientos baratos.
El descubrimiento del núcleo por Rutherford fue una sorpresa que parecía imposible. Incluso Ben Franklin se habría quedado perplejo. Todo lo que los físicos habían descubierto sobre la carga eléctrica requería que el electrón cargado negativamente entrara en espiral en un núcleo cargado positivamente en una fracción de segundo, liberando energía electromagnética en el proceso.
Pero pronto el físico danés Niels Bohr rescató al electrón de su espiral de muerte, invocando las novedosas reglas de la física cuántica.
En el átomo de Bohr, los electrones giraban alrededor del núcleo en determinadas órbitas permitidas, lo que les impedía liberar energía desplazándose hacia el núcleo. (La energía se liberaba o absorbía solo cuando un electrón saltaba de una órbita permitida a otra).
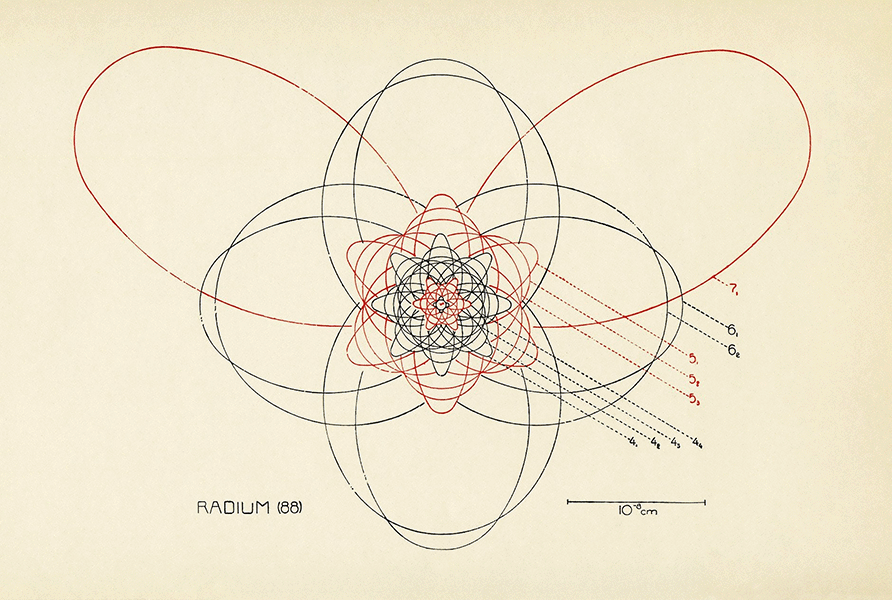
El físico danés Niels Bohr intentó explicar el papel del electrón en la estructura atómica como un conjunto de trayectorias orbitales alrededor de un núcleo central, como en el caso del elemento radio que se muestra en este dibujo de época. Tras la introducción de la mecánica cuántica hace un siglo, las órbitas precisas fueron sustituidas por niveles de energía del electrón sin trayectorias específicas.
CRÉDITO: H. HOLST ET AL / THE ATOM AND THE BOHR THEORY OF ITS STRUCTURE 1923
La idea de Bohr (como él bien sabía) era preliminar. Sus matemáticas no funcionaban con átomos más complicados que el hidrógeno. Pero un enfoque más complejo, iniciado por el físico alemán Werner Heisenberg en 1925, estableció la mecánica cuántica como el libro de reglas para el comportamiento de los electrones. Poco después, los químicos empezaron a aplicar las matemáticas cuánticas para explicar cómo los electrones mediaban en la unión entre átomos para formar compuestos químicos.
Pero el electrón no había terminado con sus sorpresas. Incluso antes de que Heisenberg construyera su imagen del átomo con electrones como partículas, el físico francés Louis de Broglie sugirió que los electrones podrían viajar por el espacio como ondas. Poco después de la aparición del trabajo de Heisenberg, el físico austriaco Erwin Schrödinger ideó un modelo ondulatorio del átomo. La matemática ondulatoria de Schrödinger daba exactamente los mismos resultados que la imagen de partículas de Heisenberg.
La verificación experimental de la imagen ondulatoria no tardó en llegar de mano de Clinton Davisson y sus colegas de los Laboratorios Bell y, de forma independiente, de George Thomson de la Universidad de Aberdeen, en Escocia. Ambos demostraron que los haces de electrones enviados a través de un cristal se desviaban de su trayectoria para formar un patrón de difracción, algo que solo podían producir las ondas.
Davisson y Thomson recibieron el Premio Nobel de Física en 1937. Fue una de las grandes ironías de la historia de la física: J.J. Thomson ganó el Nobel en 1906 por demostrar que los electrones son partículas; su hijo George ganó el Nobel en 1937 por demostrar que los electrones son ondas.
Bohr propuso en 1927 una salida a este enigma. Argumentó que tanto la imagen de onda como la de partícula eran correctas, pero que solo se aplicaban a disposiciones experimentales mutuamente excluyentes. Se podía diseñar un experimento que demostrara que el electrón es una onda, o se podía diseñar uno que demostrara que es una partícula, pero no se podía construir un experimento que revelara tanto la onda como la partícula al mismo tiempo.
La solución de Bohr, llamada complementariedad, resolvió el problema por el momento, pero dio lugar a un siglo de debates sobre cómo interpretar las matemáticas de la mecánica cuántica.
A pesar de las continuas controversias interpretativas, la física cuántica acabó madurando hasta convertirse en el motor de una tecnología exótica basada en el electrón. La miniaturización de los circuitos electrónicos, desde sus orígenes en voluminosos tubos de vacío hasta los ordenados transistores y minúsculos circuitos integrados, fue testigo de una avalancha de revoluciones tecnológicas, junto con una comprensión más profunda del mundo natural.
El comportamiento de los electrones impregna todos los ámbitos de la naturaleza, desde las propiedades químicas de los átomos hasta la complejidad de las moléculas biológicas. La comprensión del electrón permitió la era de los materiales de diseño, la electrónica de consumo y la prodigiosa potencia computacional. Desde el correo electrónico a los microscopios electrónicos, pasando por las celdas eléctricas solares a los láseres, los electrones han sido el ingrediente clave de la modernidad.
Como Benjamin Franklin previó, su “fluido eléctrico” ofrecería algún día a la humanidad una amplia recompensa por perseguir sus propiedades. “Todavía no conocemos bien los usos beneficiosos de este Fluido Eléctrico”, escribió, “aunque sin duda los hay y grandes”.
Artículo traducido por Debbie Ponchner
10.1146/knowable-042225-1
Apoye a la revista Knowable
Ayúdenos a hacer que el conocimiento científico sea accesible para todos
DONAREXPLORE MÁS | Lea artículos científicos relacionados