¿Qué pasaría si toleráramos las enfermedades?
Las células inmunitarias que combaten bacterias y virus son bien conocidas. Pero algunos científicos creen que deberíamos dedicar más atención a una segunda línea de defensa: una que permite que nuestro organismo conviva de manera más inofensiva con los patógenos hasta que se eliminan de nuestros sistemas.
Manténgase informado
Suscríbase al boletín de noticias de Knowable en español
Cuando las personas piensan en enfermedades infecciosas —como muchas lo han hecho en los últimos tres años—, piensan principalmente en el sistema inmunitario. Se supone que la gravedad de la enfermedad para un individuo depende de cuán capaz sea su sistema inmunitario de detectar, atacar y eliminar el patógeno invasor.
Se dice que el sistema inmunitario resiste las enfermedades. La resistencia reduce la cantidad de patógenos que residen dentro de un hospedero, lo que restringe la progresión de la enfermedad, promueve la recuperación o previene totalmente las infecciones. Las personas inmunodeprimidas temen a las infecciones porque no pueden resistir eficazmente a los patógenos.
Y las vacunas funcionan porque enseñan a los sistemas inmunitarios a reconocer —y así resistir de manera más efectiva— a los patógenos antes de enfrentarse a un patógeno real.
Pero siempre ha habido problemas persistentes al relacionar tan directamente la enfermedad con la abundancia de patógenos en un hospedero. Y cuando Janelle Ayres, fisióloga que ahora trabaja en el Instituto Salk en San Diego, ingresó a la escuela de posgrado hace 20 años, estas anomalías le molestaban. “Estaba muy interesada en la suposición o la idea convencional de que todo lo que se necesita para sobrevivir a una infección es matar al patógeno”, dice. “Estaba interesada porque claramente hay ejemplos en humanos y modelos animales en los que esto es demasiado simplista”.
Lo más evidente es que hay infecciones asintomáticas. Mucho antes de que supiéramos que ciertas personas infectadas con el SARS-CoV-2 no desarrollan síntomas ocurrió el famoso caso de la cocinera neoyorquina Mary Mallon. Bautizada como “Mary, la tifoidea” (“Typhoid Mary”), Mallon vivió, sin saberlo, con una infección por Salmonella Typhi a principios del siglo XX y, con buena salud, transmitió la bacteria a docenas de personas, algunas de las cuales murieron.
Por el contrario, puede haber reacciones exageradas a una infección —por ejemplo, en la sepsis, cuando la respuesta inmunitaria es dramáticamente desproporcionada con respecto a la infección y la inflamación que se desencadena en todo el cuerpo provoca un daño grave en los tejidos hospederos—. A menudo, el patógeno causante virtualmente es eliminado, pero la respuesta inmunitaria excesiva y desadaptativa continúa causando estragos potencialmente mortales.
Ayres encontró en David Schneider, un experto en enfermedades infecciosas, un supervisor de doctorado que deseaba ir más allá de solo estudiar la inmunología. Schneider quería considerar las formas en que los animales interactúan con los microbios que crecen dentro y sobre ellos, ya sean inofensivos, beneficiosos o causantes de enfermedades. Juntos, Schneider y Ayres, ayudaron a despertar el interés en un mecanismo de defensa que, en la actualidad, consideran fundamental para la salud y la resiliencia: la capacidad no de resistir una infección sino de tolerarla.
Schneider, de la Universidad de Stanford, ya había contribuido a establecer a las moscas de la fruta y su genética increíblemente bien caracterizada como modelo para estudiar enfermedades infecciosas. Pero había comenzado a pensar que las personas que usaban este sistema se habían centrado demasiado en emplearlo únicamente para identificar nuevos genes involucrados en la respuesta inmunitaria. “Traté de hacer una pregunta más general”, cuenta, “y dije: ‘¿Qué se necesita para que la mosca sobreviva cuando le provocas una infección?’”
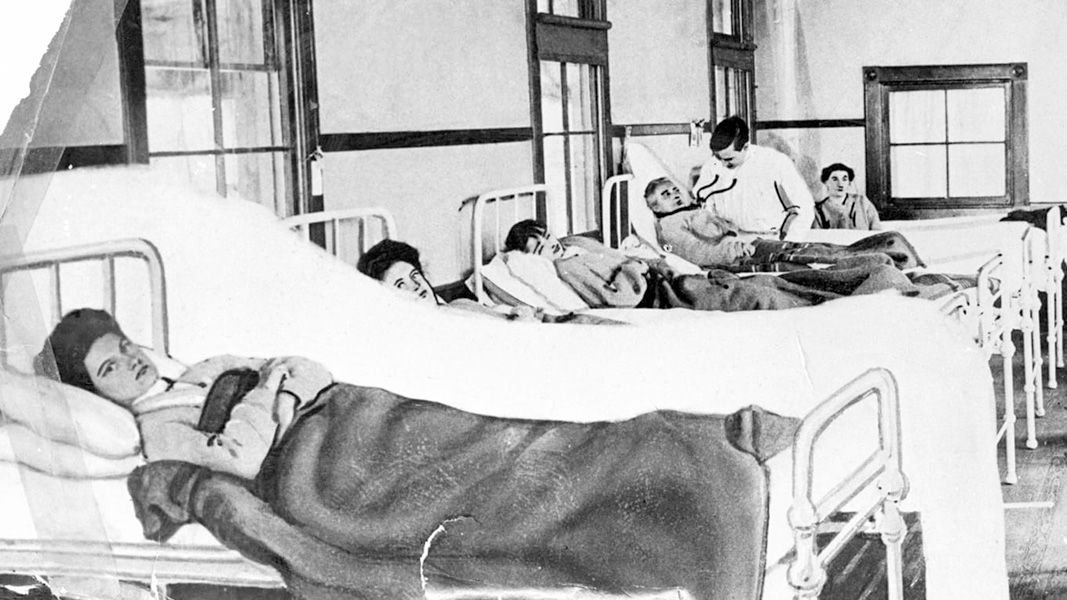
Mary Mallon, una cocinera a principios del siglo XX, era portadora asintomática de Salmonella Typhi, la bacteria que causa la fiebre tifoidea. Retratada aquí en una sala de hospital, vivió décadas en cuarentena después de negarse a dejar de trabajar como cocinera.
CRÉDITO: WIKIMEDIA COMMONS
Para abordar esta pregunta, Ayers trabajó en su doctorado con más de 1.200 cepas de moscas —cada una con una mutación genética diferente— y las infectó con el patógeno Listeria monocytogenes. Luego registró cuánto tiempo tardaron las moscas en morir. Dieciocho cepas murieron más rápido que el promedio. Después, Ayres contó cuántas bacterias habían crecido en cada una de las cepas más vulnerables.
En 12 de ellas encontró que los niveles bacterianos eran más altos de lo normal —lo que indica que en esas moscas, las mutaciones habían comprometido el sistema inmunitario y permitieron que las bacterias se multiplicaran sin control—. En las seis cepas restantes, sin embargo, los niveles de Listeria eran normales.
Estas moscas mutantes eran opuestas a “Mary, la tifoidea”. Mientras que su cuerpo había sido capaz de manejar una infección sin signos de enfermedad, esas moscas morían por niveles de patógenos que no deberían haber sido fatales. Sus respuestas inmunitarias eran normales, pero parecían carecer de algún tipo de rasgo de resiliencia que normalmente permitía que las moscas sobrevivieran a esta infección.
Fue un experimento que marcó la dirección de la carrera de Ayres porque, dice ella, “sugirió que hay genes que un hospedero animal ha desarrollado y que son importantes para tolerar una infección”.

“Es fácil describir lo que es un individuo enfermo”, dice la investigadora Janelle Ayres, del Instituto Salk, fotografiada aquí en su laboratorio. “Pero, ¿cómo puede haber un individuo que… tiene un patógeno, pero está sano? ¿Cómo se describe eso de manera mecanicista? ¿Qué está sucediendo?”.
CRÉDITO: INSTITUTO SALK
La naturaleza de estos sistemas, cómo funcionan y cómo se controlan son preguntas que han ocupado a Ayres, Schneider y a un pequeño, pero creciente, número de investigadores desde entonces. “Es fácil describir lo que es un individuo enfermo. Conocemos los mecanismos que conducen a la enfermedad”, dice Ayres. “Pero, ¿cómo puede haber un individuo que… tiene un patógeno, pero está sano? ¿Cómo se describe eso de manera mecanicista? ¿Qué está sucediendo?”
En la actualidad hay un cuerpo sustancial de investigación que muestra varias formas en que los animales pueden tolerar, y así sobrevivir, enfermedades como la malaria, la sepsis y la disentería. Y aunque existe la sensación entre los científicos que trabajan en este campo de que sus hallazgos aún no han influido en el trabajo sobre enfermedades infecciosas tanto como les gustaría, son optimistas de que su investigación podría ayudar a forjar nuevas terapias médicas importantes. “Ojalá estemos encontrando mecanismos centrales que nos protejan contra las enfermedades infecciosas”, dice Miguel Soares, inmunólogo del Instituto de Ciencias Gulbenkian, en Portugal, coautor de un artículo sobre la tolerancia a las enfermedades en el Annual Review of Immunology de 2019.
De hecho, Soares espera que la investigación básica ya haya identificado una de esas formas. Un fármaco que permite a los ratones sobrevivir a la sepsis mediante la activación de los mecanismos de resiliencia intrínsecos de los animales se encuentra ahora en estudio en humanos: es el primer ensayo clínico que nace directamente de la investigación en la tolerancia a enfermedades.
Replantear una vieja idea
Schneider y Ayres no inventaron el concepto de tolerancia a la enfermedad. De hecho, ya tenía más de un siglo de antigüedad. Como estudiante de posgrado, Ayres leyó una investigación de un científico estadounidense peripatético llamado Nathaniel Augustus Cobb. A fines del siglo XIX, trabajando para el recién fundado Departamento de Agricultura de Nueva Gales del Sur, en Australia, Cobb había intentado aumentar la productividad de las granjas locales. Al hacerlo, describió ciertas cepas de trigo que desarrollaron persistentes infecciones causadas por hongos, pero siguieron creciendo y cosechando —el patógeno estaba allí, pero apenas disminuía la vitalidad de las plantas—.
A lo largo del siglo XX, los científicos especializados en plantas adoptaron y diseccionaron este mecanismo de defensa, pero la idea nunca caló entre los que estudian animales. Después de todo, los animales tienen sistemas inmunitarios —y en eso se centró la investigación clínica y en animales—.
Las criaturas que mejor toleran las infecciones se mantienen saludables incluso cuando sus organismos tienen niveles de patógenos que enfermarían o matarían a otros de su especie. Los investigadores quieren comprender la naturaleza de esos mecanismos de protección.
Después, justo cuando Schneider y Ayres estaban explorando este concepto en moscas de la fruta, un grupo de la Universidad de Edimburgo, en Escocia, publicó un trabajo similar en mamíferos. El estudio examinó lo que sucedió cuando varias cepas de ratones se infectaron con el parásito Plasmodium, que causa la malaria. Algunas cepas de ratones habían tolerado altos niveles del parásito antes de enfermarse, mientras que, en otras, niveles bajos habían causado la enfermedad. Los autores concluyeron que, en los ratones, el nivel de patógenos por sí solo no podía explicar la gravedad de la enfermedad —eso significa que en los mamíferos la gravedad de la enfermedad también varía según lo bien que toleran un patógeno, y esta variabilidad está controlada genéticamente—.
Estas demostraciones gemelas de que la tolerancia a las enfermedades se aplica tanto a los animales como a las plantas fue una “conclusión muy simple, pero muy profunda”, dice Soares. “¡Ahí fue cuando todos nos despertamos!”.
En primer lugar, el trabajo de repente ofreció un nuevo marco en el que reinterpretar datos antiguos, a veces desconcertantes.
Soares estudia principalmente la malaria y la sepsis —enfermedades que, respectivamente, matan a 600.000 y 11 millones de personas al año—. Antes, el experto había descubierto que cuando los ratones se infectaban con el parásito que causa la malaria, aumentaba la actividad de un gen crítico para metabolizar el hierro. Esto permitió a los ratones manejar mejor los niveles elevados de hierro libre en el torrente sanguíneo provocados por la infección, mejorando así las tasas de supervivencia.
De repente, esto parecía un ejemplo de tolerancia. Y este tipo de comprensión mecanicista detallada era exactamente lo que se necesitaba para pasar de una idea (los animales tienen defensas no mediadas por células inmunitarias contra el daño provocado por patógenos que han colonizado sus cuerpos) a un campo maduro de la biología (así es cómo los animales toleran los patógenos).
Soares destaca que quienes defienden la tolerancia a las enfermedades no están minimizando la centralidad de la inmunidad. En realidad, proponen que estos dos sistemas de protección trabajan juntos. También es firme en su afirmación de que las vacunas y los medicamentos antimicrobianos siguen siendo las formas más poderosas para combatir las enfermedades infecciosas. “Pero en algunos casos”, dice Soares, “eso no es suficiente”. Lo que quiere son formas adicionales de restringir la enfermedad que causa una infección.
Ayres, Soares, Schneider y otros expertos ahora han analizado múltiples patógenos y se han preguntado cómo responden los organismos de los animales frente a ellos. Han encontrado varios medios por los cuales se mantienen saludables —o no lo logran—. A menudo, estos mecanismos son complejos, pero eso no debería ser una sorpresa, agregan: el daño directo causado por los patógenos induce una serie de reacciones fisiológicas que, a su vez, tiene numerosos efectos colaterales. Y todas estas cosas pueden ser importantes. Con frecuencia, está involucrada la biología de todo el animal, no solo los sistemas de órganos que son atacados por el invasor. Por eso se están haciendo avances para mapear estas vías multifacéticas.
Este cuadro describe el concepto básico de tolerancia a la enfermedad en animales. Cuando los patógenos infectan el cuerpo, activan el sistema inmunitario, que responde con medidas de resistencia para combatir el agente dañino. Ese microorganismo puede enfermar al animal —pero también puede hacerlo el sistema inmunitario, por ejemplo, al inducir inflamación—. En la tolerancia a la enfermedad, el animal individual y/o la especie puede responder con reacciones fisiológicas y adaptaciones que atenúan las consecuencias negativas de estos eventos, de modo que la criatura se mantenga saludable —¡o al menos más saludable!— ante la presencia de recuentos elevados de patógenos. Eliminar el patógeno del cuerpo sigue siendo importante, pero el animal sufrirá menos efectos nocivos mientras ese proceso está en desarrollo.
Dulce éxito
Inicialmente, el grupo de Soares se centró en el hierro de manera exhaustiva en su estudio sobre malaria y sepsis. Cada enfermedad puede causar la descomposición de los glóbulos rojos que contienen este compuesto, lo que libera hemoproteínas que contienen hierro que deben ser procesadas para que el organismo sobreviva. Pero hay una trampa. La neutralización de las proteínas libera hierro libre, que es tóxico para el hospedero y también es un mineral que las bacterias y otros parásitos necesitan para sobrevivir. Así, procesar estas proteínas que contienen hierro supone un delicado equilibrio entre tolerar y sucumbir a la enfermedad.
En un artículo de 2017, Soares y sus colegas encontraron dos tratamientos que permitieron que los ratones sobrevivieran mejor a la sepsis. El primero fue tratarlos con una proteína que absorbe el hierro de manera segura. El segundo fue darles glucosa.
“A las bacterias les gusta la glucosa”, dice Soares. Por lo tanto, el organismo a menudo deja de producir glucosa cuando está infectado, y las infecciones con frecuencia hacen que los animales pierdan el apetito. Estas acciones simultáneas limitan la fuente de energía del patógeno y, por lo tanto, ayudan a la supervivencia del hospedero.
En su modelo de sepsis, el laboratorio de Soares halló que los cambios en el metabolismo del hierro habían causado una disminución de la producción de glucosa en el hígado —pero observaron que eso podría ir demasiado lejos—. “Descubrimos que se puede bajar la glucosa, pero no se puede reducir por debajo de cierto nivel. Por debajo de ese umbral desarrollas hipoglucemia y mueres”, dice Soares. Cuando Sebastian Weis, un estudiante de postdoctorado que trabajaba en su laboratorio, les dio azúcar a los ratones moribundos, los animales se recuperaron y vivieron.
Esa intervención no ayuda al hospedero a eliminar las bacterias que causan la enfermedad; más bien, les permite seguir funcionando hasta que el patógeno desaparezca. Es, en otras palabras, fomentar la tolerancia a la enfermedad.

Muchos experimentos de tolerancia a la enfermedad se realizan en ratones de laboratorio. Se ha encontrado, por ejemplo, que las criaturas son más capaces de tolerar la infección bacteriana sistémica conocida como sepsis si se les da glucosa y una proteína para absorber el hierro. Se está probando en humanos un fármaco que permite a los ratones sobrevivir a la sepsis al activar la respuesta de control del daño tisular del organismo.
CRÉDITO: ISTOCK.COM / UNOL
Otros trabajos han reportado que mantener la glucosa en sangre en un rango funcional también es clave para tolerar otras infecciones; es probable que las respuestas precisas sean específicas de cada patógeno, dice Soares. Ayres, entre tanto, ha demostrado cuán rica y dinámica puede ser la relación entre el hospedero y un parásito —y cómo los niveles de glucosa pueden ser clave para esa interacción—.
Para empezar a estudiar una nueva enfermedad, Ayres emplea un ingenioso sistema experimental que implica dar a un grupo de ratones genéticamente idénticos una dosis del patógeno que sabe que matará a la mitad de ellos. Después compara las reacciones de los que sobreviven y los que no sobreviven para preguntar qué hizo la diferencia crítica entre la vida y la muerte.
Cuando decidió usar este enfoque para investigar una cepa de Citrobacter —un patógeno que afecta a ratones y que comparte factores de virulencia con cepas de E. coli que pueden causar enfermedades en las personas— “pensé que con seguridad todos los animales se enfermarían y luego algunos se recuperarían”, dice Ayres.
Pero eso no fue lo que sucedió. Los ratones que vivieron nunca se enfermaron. Lo que fuera que los estaba protegiendo los mantuvo saludables todo el tiempo.
Como siempre sucede con un experimento de este tipo, el equipo de Ayres comprobó si los ratones sobrevivientes simplemente habían montado una respuesta inmunitaria más rápida y eficaz. Pero hallaron que la cantidad de Citrobacter en los animales que habían muerto y los que habían sobrevivido era la misma. Sus respuestas inmunitarias fueron equivalentes.
Volviendo al metabolismo de los animales, el equipo de Ayres vio que los animales que sobrevivieron habían cambiado la forma en que metabolizaban el hierro, y que eso, a su vez, les había hecho producir más glucosa libre circulante.
Para explorar las consecuencias de esto, Ayres se preguntó qué efecto tenían los niveles elevados de azúcar en la Citrobacter. “Cuando estudias las interacciones hospedero-patógeno, o cualquier sistema en el que interactúan dos entidades, es muy importante considerar ambos lados”, dice. Resultó que cuando esas bacterias en particular cubrieron sus demandas de energía, apagaron sus mecanismos de virulencia que causan la enfermedad. Las bacterias habían dejado de ser invasores patógenos y se habían convertido, en cambio, en microbios esencialmente inofensivos que coexistían con su hospedero sano.
Pero si bien esto sugirió una forma de proteger a las personas infectadas con Citrobacter, el resultado planteó una posibilidad preocupante. ¿Qué pasaría si los ratones sobrevivientes se convirtieran en reservorios ambulantes de bacterias letales, básicamente como pequeñas “Mary, la tifoidea” murinas, capaces de propagar enfermedades?
Al tolerar una infección, “estamos evitando esa interminable carrera armamentista entre el patógeno y el hospedero”.
inmunóloga Elina ZunigaEn cambio, Ayres halló algo bastante diferente. La Citrobacter en ratones tolerantes rápidamente se volvió menos virulenta. Y cuando las bacterias de ratones tolerantes se transfirieron a ratones no infectados, no causaron enfermedad. En otras palabras, parecía que las bacterias bien alimentadas que se multiplicaban felizmente en sus hospederos se habían adaptado rápido a vivir de esa manera, reduciendo crónicamente su virulencia. Ayres llama “soborno metabólico” a esa forma en que los cambios en el azúcar y el hierro regulan a la Citrobacter.
“Ese concepto me pareció genial”, dice Elina Zuniga, inmunóloga de la Universidad de California, en San Diego, que no participó en el trabajo. Zuniga destaca cómo, cuando el sistema inmunitario suprime a los patógenos, arrincona al microbio, presionándolo para que evolucione con más virulencia. Pero al tolerar una infección, señala Zuniga, “estamos evitando esa interminable carrera armamentista entre el patógeno y el hospedero”.
Desde una perspectiva científica, estos estudios ofrecen información importante sobre la biología de la enfermedad y cómo se conforma la trayectoria de una infección. Pero en términos de su utilidad clínica, Weis —colega de Soares, que ahora divide su tiempo entre la investigación básica y el trabajo como especialista en enfermedades infecciosas en el Hospital Universitario de Jena en Alemania— es contundente. “La historia de la glucosa es aburrida para los médicos”, dice, y en muchos sentidos, controlar la hipoglucemia y la hiperglucemia ya es algo de sentido común clínico.
Lo que quieren los médicos, dice Weis, son nuevos medicamentos —y él está dirigiendo el primer ensayo clínico que podría introducir uno para tratar la sepsis—.
Activando las defensas
La investigación de Weis con Soares sugirió que las personas con sepsis podrían beneficiarse, al igual que los ratones, de las proteínas que absorben el hierro libre. Pero como no conocía ninguna proteína disponible para pruebas clínicas, optó por un enfoque alternativo.
En cambio, se centró en lo que él llama la respuesta de control de daños en los tejidos —otro mecanismo que cree que es elemental para la tolerancia a las enfermedades—.
El laboratorio de Soares halló que un gen llamado Nrf2 se activa en las células que sufren algún tipo de estrés, y que este gen ayuda a proteger las células. Nrf2 controla toda una red de genes que cumplen una función de control de daños, y esta red parece activarse cada vez que los tejidos están bajo estrés.
Soares observó por primera vez esta respuesta de control de daño tisular en ratones con malaria. Lo que es crítico al respecto, dice, es que “no toca al patógeno. Tan solo protege al organismo del daño”. Eso incluye el daño causado directamente por patógenos, así como el daño colateral inevitable mediado por un sistema inmunitario activado y por la inflamación. Esta lesión colateral es lo que hace que la sepsis sea tan peligrosa.
La investigación sugirió que, si hubiera una forma de activar el sistema de control de daño tisular, podría reducir la gravedad de la enfermedad. Y al parecer existía esa manera. En 2013, un grupo portugués que Soares conoce bien demostró que los ratones con sepsis podrían salvarse si se les administra epirubicina —un medicamento usado desde hace 40 años en quimioterapia—. La epirubicina induce daño en el ADN, lo que en dosis altas mata a las células cancerosas. Sin embargo, en dosis más bajas parece alterar las cosas lo suficiente como para activar la respuesta de control de daños en los tejidos, protegiendo así a los ratones y evitando que la sepsis los mate.
“La forma en que percibimos esto”, dice Weis, “es que si tienes una infección y tu sistema puede adaptarse al estrés asociado con esa infección, no sufrirás una falla orgánica”.
Weis ahora está comenzando un ensayo clínico para ver si esto es cierto en humanos. La gran ventaja de usar epirubicina es que ya se emplea en humanos. La desventaja es que los reguladores le dijeron a Weis que debe comenzar con dosis muy bajas para garantizar que sea seguro en pacientes con sepsis. Piensa que en el transcurso del próximo año tendrá datos sobre la seguridad (de la droga) a partir de unos 45 pacientes, además de datos que indiquen si la epirubicina, efectivamente, induce mecanismos de control de daño tisular en las personas.
Si todo va bien, Weis probará si el medicamento mejora o no los resultados de la sepsis.
Los investigadores en este campo mantendrán sus antenas alertas para hallar otras formas de aprovechar la ciencia a nivel clínico, incluso mientras continúan impulsando la biología fundamental. Ayres, por ejemplo, al principio de la pandemia escribió sobre la necesidad de encontrar maneras de proteger a las personas con Covid-19 del daño causado por sus propias respuestas inmunitarias; los antiinflamatorios como la dexametasona, de hecho, han salvado vidas. Y ahora está intentando incorporar los mecanismos de tolerancia a la enfermedad en una nueva visión de lo que ella llama la biología de la salud fisiológica.
Ayres también reflexiona sobre lo que está sucediendo en su diseño experimental, donde los ratones genéticamente idénticos tienen una probabilidad de 50-50 de sobrevivir a varios tipos de infecciones. ¿Qué inclina la balanza hacia un lado o hacia el otro? “¿Es algo preexistente? ¿O es algo que sucede en la infección antes de que (los ratones) sean sintomáticos?”, se pregunta. Hay múltiples cosas para observar, agrega, desde las bacterias que crecen en los intestinos de los animales —sus microbiomas— hasta sus interacciones sociales, las diferencias metabólicas individuales o tal vez incluso cuándo comieron por última vez. “Realmente queremos saber”, enfatiza.
Artículo traducido por Daniela Hirschfeld
10.1146/knowable-061423-2
Apoye a la revista Knowable
Ayúdenos a hacer que el conocimiento científico sea accesible para todos
DONAREXPLORE MÁS | Lea artículos científicos relacionados