Los genes saltarines rebeldes pueden acelerar el alzhéimer y la esclerosis lateral amiotrófica
Nuestros genomas están salpicados de segmentos de ADN llamados retrotransposones que pueden desplazarse de un lugar a otro. Cuando se liberan, algunos pueden matar nervios y promover la inflamación —un descubrimiento que podría inspirar tratamientos contra la neurodegeneración—.
Manténgase informado
Suscríbase al boletín de noticias de Knowable en español
En 2008, la neuróloga Renée Douville observó algo extraño en los cerebros de personas que habían fallecido a causa de eesclerosis lateral amiotrófica, un trastorno del movimiento: proteínas víricas.
Pero estas personas no habían contraído ningún virus conocido.
En su lugar, genes ancestrales procedentes de virus, y que aún acechaban en los cromosomas de estos pacientes, habían despertado y empezado a producir proteínas víricas.
Nuestros genomas están llenos de restos de virus desaparecidos hace mucho tiempo, descendientes de infecciones víricas de hace millones de años. La mayoría de estos fragmentos de lo que alguna vez fue ADN foráneo son conocidos como retrotransposones y constituyen más del 40 % del genoma humano.
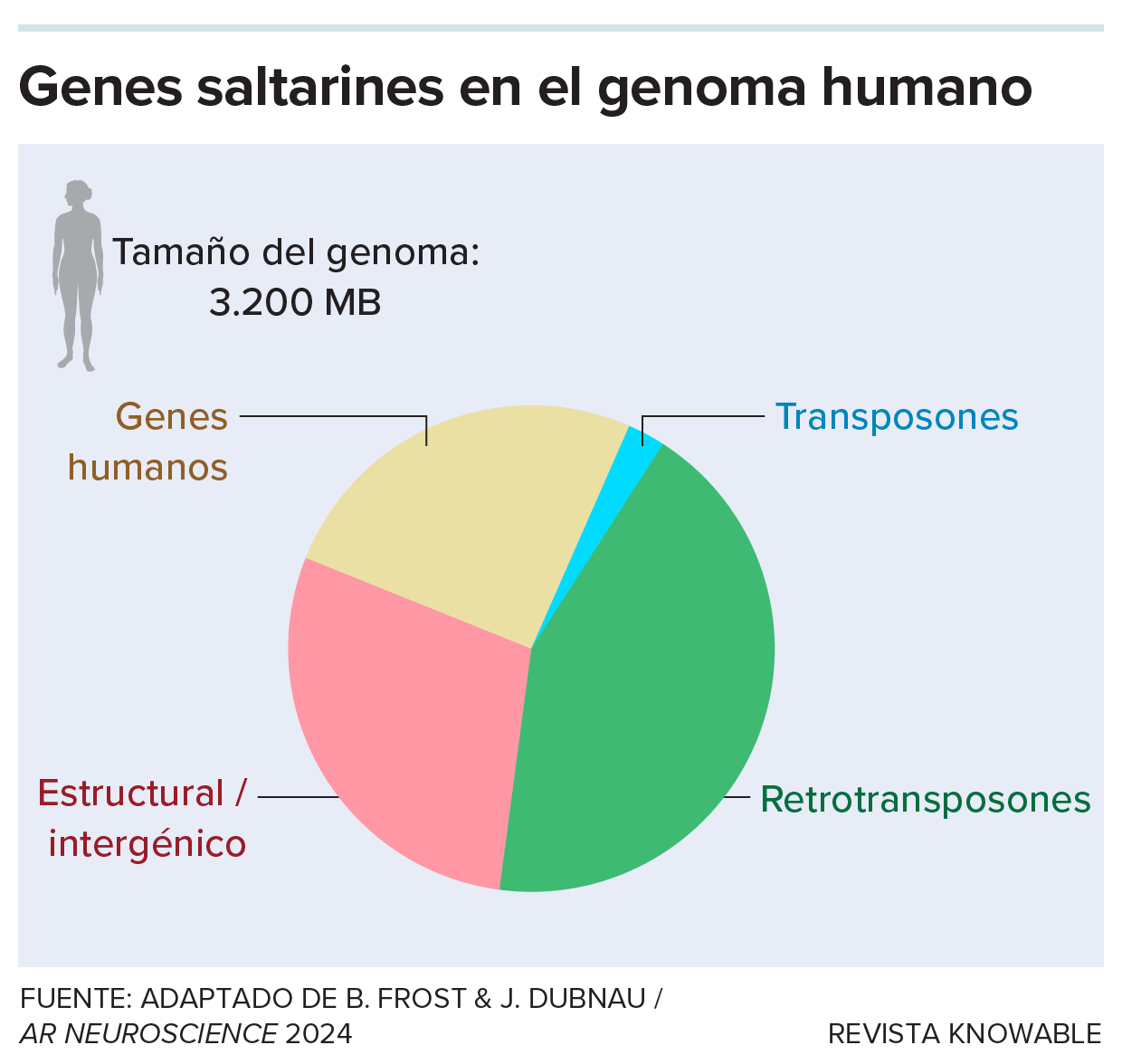
Nuestros genomas están plagados de ADN procedente de antiguas infecciones víricas conocidas como genes saltarines. La mayoría son retrotransposones, que se copian a sí mismos a través de intermediarios de ARN.
Muchos retrotransposones parecen inofensivos, la mayor parte del tiempo. Pero Douville y otros investigadores están estudiando la posibilidad de que algunos retrotransposones reactivados puedan causar graves daños: pueden degradar las células nerviosas y desencadenar inflamaciones, y podrían ser la causa de algunos casos de alzhéimer y ELA (esclerosis lateral amiotrófica o enfermedad de Lou Gehrig).
La teoría que relaciona los retrotransposones con las enfermedades neurodegenerativas —afecciones en las que las células nerviosas disminuyen o mueren— aún está en desarrollo; incluso sus defensores, aunque optimistas, se muestran cautos. “Aún no es una opinión consensuada”, afirma Josh Dubnau, neurobiólogo de la Facultad de Medicina Renaissance de la Universidad Stony Brook de Nueva York. Y los retrotransposones no pueden explicar todos los casos de neurodegeneración.
Sin embargo, cada vez hay más pruebas de que pueden subyacer en algunos casos. Ahora, tras más de una década estudiando esta posibilidad en tejido cerebral humano, moscas de la fruta y ratones, los investigadores están sometiendo sus ideas a la prueba definitiva: ensayos clínicos en personas con ELA, alzhéimer y afecciones relacionadas. Estos ensayos, que toman prestados medicamentos antirretrovirales de la farmacopea del VIH, han arrojado resultados preliminares, pero prometedores.
Mientras tanto, los científicos siguen explorando cómo un despertar vírico se convierte en una enfermedad en toda regla, un proceso que puede estar marcado por lo que Dubnau y otros denominan una “tormenta de retrotransposones”.
Genes que saltan
Un retrotransposón es una especie de “gen saltador”. Estos fragmentos de ADN pueden (o en algún momento podían) desplazarse por el genoma copiándose o eliminándose de un lugar y pegándose en otro nuevo. Los retrotransposones son expertos en copiar y pegar.
Muchos retrotransposones son viejos compañeros: algunos son anteriores a la evolución del Homo sapiens o incluso a la separación entre plantas y animales, afirma Dubnau. Sus predecesores pueden haber alternado entre viajar pegados a un cromosoma huésped y existir fuera de él, sugiere ella.
Algunos retrotransposones, después de todo ese tiempo, conservan su capacidad de saltar por el ADN humano. Para ello, se copian a sí mismos con la enzima transcriptasa inversa, que también utilizan algunos virus como el VIH para copiar secuencias de ARN en ADN. Una vez copiados, los virus remanentes pueden saltar a nuevas ubicaciones en los cromosomas.
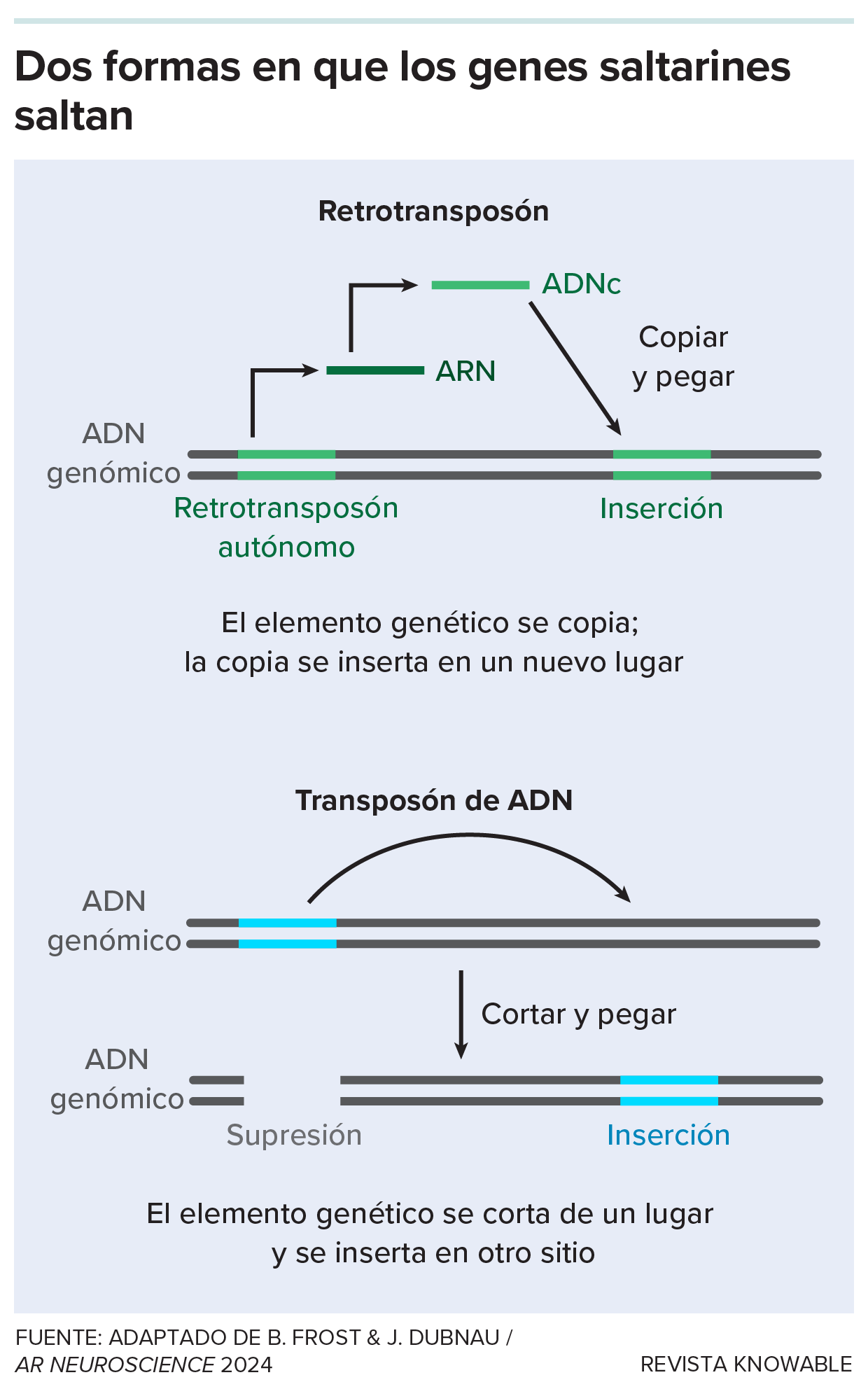
Los genes saltarines utilizan distintos mecanismos para desplazarse por el genoma.
Si le aterra pensar en un genoma plagado de genes retrovirales, algunos capaces de rebotar por el genoma, no se preocupe, dice Douville, ahora en la Universidad de Manitoba en Winnipeg. Sorprendentemente, algunos retrotransposones han asumido tareas útiles, ayudando al organismo en tareas como el mantenimiento de las células madre y el desarrollo del embrión y el sistema nervioso.
Y muchos retrotransposones están inactivos o rotos, y la célula tiene medios para mantenerlos (en su mayoría) en silencio. Una técnica consiste en esconderlos en regiones de ADN que están tan enrolladas que las máquinas moleculares necesarias para copiar genes no pueden acercarse a ellas.
En esencia, la célula las mete en un armario y cierra la puerta de un portazo.
Pero cada vez hay más pruebas de que, a medida que las personas envejecen, la puerta del armario puede abrirse y dejar salir retrotransposones. No se sabe con certeza qué hacen exactamente. Algunos científicos creen que no es tanto que estén saltando y mutando el ADN, sino que su ARN y proteínas con tintes virales pueden estropear las actividades celulares normales.
“Creo que lo que realmente provoca la toxicidad cuando se activan los transposones es que producen todos estos factores que a la célula le parecen que son un virus”, afirma Bess Frost, neurobióloga de la Universidad Brown de Providence, Rhode Island. La célula reacciona, razonablemente, con una inflamación defensiva, que suele asociarse a la neurodegeneración.
Los retrotransposones también parecen aliarse con las proteínas clásicamente relacionadas con la neurodegeneración, dañando o matando las células nerviosas, y quizás incluso desencadenando la enfermedad en primer lugar.
Haciendo una conexión con la ELA
Los científicos sospechaban desde hacía tiempo que existía una relación entre los virus y la ELA, que provoca la degeneración de las neuronas motoras que controlan el movimiento. Pero la conexión, cuando finalmente se descubrió, no era exactamente la que nadie había previsto.
A principios de la década de 2000, científicos informaron que algunas personas con ELA tenían la enzima viral transcriptasa inversa en la sangre y, más raramente, en el líquido cefalorraquídeo. Algunos tenían tanta transcriptasa inversa como una persona infectada por el VIH.
Pero en aquel momento, dice Dubnau, “nadie pudo encontrar un virus”.
Finalmente, Douville y sus colegas descubrieron pruebas de la presencia de uno de esos virus sobrantes, un tipo de retrotransposón llamado HERV-K, en los cerebros de algunas personas que habían muerto de ELA. A partir de ahí, los científicos empezaron a construir un caso que vinculaba los genes saltarines con la ELA en personas, animales de laboratorio y células en placas. Un equipo informó en 2017 de que se habían activado numerosos genes saltarines en los cerebros de ciertas personas con ELA.
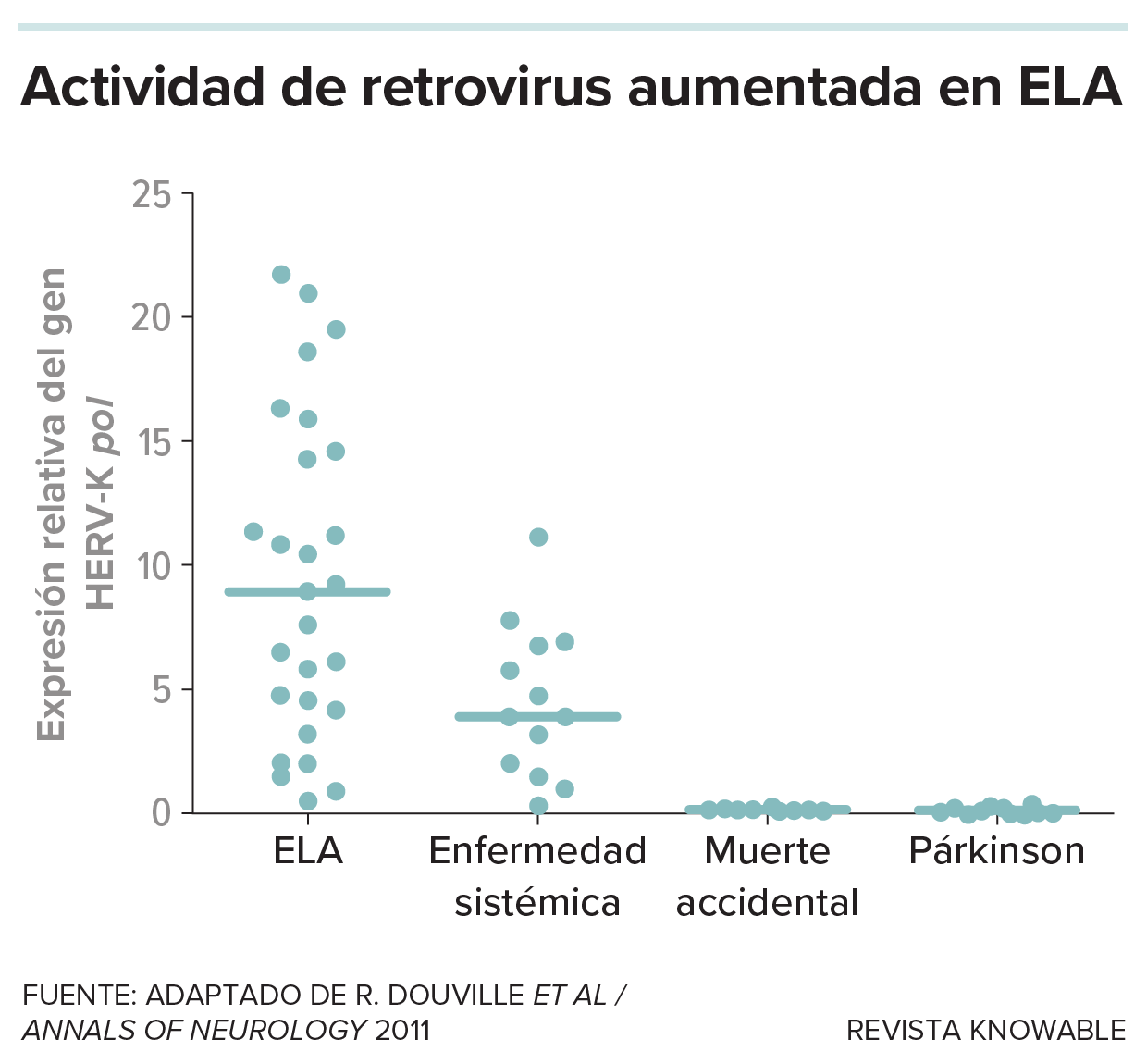
En uno de los primeros estudios en relacionar retrovirus y neurodegeneración, los investigadores buscaron pruebas de que los genes del retrovirus conocido como HERV-K se habían activado en el tejido cerebral de personas que murieron de ELA, en comparación con las que fallecieron por otras causas. La actividad de un gen del HERV-K llamado pol, que participa en el copiado del genoma retroviral, estaba más presente en muchas muestras de ELA.
Los colegas de Douville también documentaron los daños infligidos por el HERV-K: cuando introdujeron un gen del retrotransposón en ratones, las proyecciones de las células nerviosas de los animales se arrugaron y mostraron síntomas similares a los de la ELA.
Cuando los científicos se centraron en lo que podría estar despertando al HERV-K, apareció una proteína conocida. Denominada TDP-43, ya se había relacionado con la ELA. Pero incluso antes de eso, se descubrió que estaba implicada en las respuestas de las células al retrovirus VIH.
En los años noventa se descubrió que el TDP-43 actúa en el núcleo de las células, donde impide la activación de los genes del VIH. Allí también regula genes humanos. Pero en las neuronas de las personas con ELA o una enfermedad relacionada, la demencia frontotemporal (DFT), el TDP-43 abandona el núcleo y pasa a formar grumos anormales en el citoplasma. Estos grumos se han asociado a varias enfermedades neurodegenerativas y pueden propagarse de una célula a otra. Y cuando el TDP-43 abandona el núcleo, también crea un vacío en la regulación génica, alterando los niveles de actividad de muchos genes.
Basta con que el TDP-43 se estropee para causar neurodegeneración, pero los estudios indican que el abandono de su función nuclear también puede despertar a los retrotransposones. Cuando el TDP-43 abandona el núcleo, el ADN fuertemente enrollado junto a ciertos retrotransposones empieza a aflojarse y desenredarse, según reveló un estudio de células de cerebros de personas que murieron de ELA o FTD. Y los investigadores observaron que, en células cultivadas, esta pérdida de TDP-43 liberaba a ciertos retrotransposones de sus ataduras. En otras palabras, la puerta del armario estaba ahora entreabierta, lo que permitía a los retrotransposones salir y moverse.
Mientras tanto, Dubnau y sus colaboradores, examinaban los datos sobre el TDP-43 y los genes que controla en ratas, ratones y personas. Descubrieron que el TDP-43 puede adherirse de forma natural a los ARN de una variedad de genes saltarines, lo que sugiere una forma en la que el TPD-43 normal podría seguir acorralándolos, incluso si han conseguido copiarse en ARN. Esa interacción se vio alterada en personas con FTD y en roedores con cantidades anormalmente altas o bajas de TDP-43, como si el TDP-43 ya no pudiera controlar los genes saltarines.
El grupo de Dubnau también recurrió a la mosca de la fruta. Tanto la vejez como el gen humano TDP-43 hicieron que los retrotransposones del cerebro de la mosca salieran a hurtadillas del armario cromosómico, induciendo a las células cerebrales a matar a sus vecinas y provocando la neurodegeneración, según informó el grupo en una serie de artículos publicados entre 2013 y 2023. Además, la activación de ciertos retrotransposones también hacía que el TDP-43 se agrupara fuera del núcleo, creando un círculo vicioso en el que el TDP-43 y los retrotransposones se reforzaban mutuamente sus comportamientos anómalos. Pasado cierto punto, dice Dubnau, “solo despega”.
Basándose en la suma de todos estos hallazgos, Dubnau sugiere una posible vía de desarrollo de la ELA: normalmente, el TDP-43 en el núcleo ayuda a reprimir los retrotransposones. Pero si el envejecimiento o cualquier otra alteración hace que el TDP-43 decaiga, esos retrotransposones antes silenciados cobran vida y producen ARN y proteínas similares a los virus. Aunque los retrotransposones podrían inducir enfermedades por sí mismos, saltando a nuevas localizaciones de ADN o estimulando la inflamación, también actúan sobre el TDP-43. Obligan a que haya más TDP-43 en el organismo. Obligan a más TDP-43 a abandonar el núcleo y agruparse en el citoplasma, provocando una mayor neurodegeneración que se extiende a las células vecinas.
Esta no es la causa de todos los tipos de ELA, que es un trastorno complejo con muchos desencadenantes posibles. Pero en un estudio de 2019 sobre muestras cerebrales post mortem, Dubnau y sus colegas descubrieron que aproximadamente una de cada cinco personas con ELA presentaba altos niveles de activación de retrotransposones y disfunción del TDP-43.
Un vínculo con tau y el alzhéimer
Mientras se desarrollaba la historia de la ELA, otros científicos buscaban una conexión entre los retrotransposones y otra proteína tóxica en la neurodegeneración: la proteína tau, que se retuerce formando ovillos rebeldes en las células cerebrales de los enfermos de alzhéimer. Afecta a los retrotransposones porque, al igual que la TDP-43, desempeña un papel en el mantenimiento del silencio de los retrotransposones, afirma Frost.
Este mantenimiento es un efecto secundario de la asociación de tau con el esqueleto interior de la célula. Ese esqueleto está físicamente vinculado a la estructura esquelética del núcleo, que a su vez ancla el ADN fuertemente enrollado que silencia los retrotransposones. Cuando tau se estropea, cambia la estructura del esqueleto principal de la célula, haciéndolo más rígido. Frost y sus colegas descubrieron que este defecto estructural se propaga hasta el esqueleto nuclear y los cromosomas, solo que al tensar las hebras de un lado de una red podría cambiar la forma del otro lado.
Este efecto estructural puede desbloquear los trozos de cromosoma fuertemente enrollados en las moscas de la fruta, lo que daña sus neuronas, informó Frost en 2014. En 2018, ya había demostrado que los problemas de tau desencadenaban genes saltarines en las moscas.
“Estaban saltando legítimamente”, afirma, yendo de sus ubicaciones cromosómicas originales a otras en las células cerebrales de la mosca. Y los genes que saltaban contribuían a la muerte de las células nerviosas.
Frost y sus colegas también estudiaron mamíferos —ratones— y en 2022 informaron de que los retrotransposones también se activaban en ratones con tau disfuncional.
“Estaban saltando legítimamente”.
— BESS FROST
Mientras tanto, Frost y otros investigadores examinaron células cerebrales de personas que habían muerto de enfermedades relacionadas con tau, como el alzhéimer, que también revelaron retrotransposones activados.
Este despertar de los retrotransposones parece producirse en una fase temprana de la enfermedad, según el trabajo de otro equipo publicado en 2022. En muestras de sangre de personas en vías de desarrollar la enfermedad de Alzheimer, el copiado de genes retrotransposones en ARN se disparó, creando una “tormenta de retrotransposones”, solo antes de que sus síntomas empeoraran lo suficiente como para ser etiquetados como alzhéimer.
Una táctica tomada del tratamiento contra el VIH
Este creciente conjunto de pruebas sugiere que la reactivación de retrotransposones que antaño estaban silenciosos, ya sea a través de tau disfuncional o de TDP-43, puede causar estragos. Ante esto, rápidamente se viene a la mente un posible tratamiento: dado que estos retrotransposones se parecen mucho a los virus, los científicos creen que los fármacos antivirales podrían ayudar.
Afortunadamente, los médicos ya disponen de medicamentos que atacan a los retrovirus: millones de personas toman antirretrovirales para mantener a raya al VIH o impedir que se instale en sus células.
De hecho, en varios estudios realizados a lo largo de varios años se han investigado fármacos para el tratamiento del VIH que bloquean la enzima transcriptasa inversa. En células, moscas y ratones, los fármacos han reducido la actividad de los retrotransposones y la neurodegeneración.
Estos medicamentos son bien conocidos y, en general, seguros, y ya se están probando en enfermedades neurodegenerativas. Por ejemplo, investigadores han probado la seguridad de un tratamiento antirretroviral de 24 semanas en 40 personas con ELA. No solo la mayoría de las personas completaron el ensayo de forma segura, sino que los niveles de HERV-K en su sangre disminuyeron, y parecían tener un retraso en la progresión de sus síntomas de ELA, informaron los investigadores en 2019.
Frost publicó recientemente los resultados de un pequeño ensayo en el que 12 personas con enfermedad de Alzheimer en fase inicial tomaron un inhibidor de la transcriptasa inversa durante 24 semanas. Su principal objetivo era determinar si el tratamiento era seguro, y lo fue —pero los investigadores también observaron un descenso de los signos de inflamación en el líquido cefalorraquídeo de los participantes—.
Tanto Dubnau como Frost forman parte del consejo asesor científico de Transposon Therapeutics, que probó su propio inhibidor de la transcriptasa inversa en 42 personas con ELA y/o ETF. La empresa afirma que el fármaco fue tolerable y produjo signos de menor neurodegeneración e inflamación, además de un retraso en el inevitable empeoramiento de los síntomas. La empresa está planeando un ensayo más amplio; también tiene previsto probar su fármaco en personas con ELA, alzhéimer y una enfermedad relacionada basada en la tau, la parálisis supranuclear progresiva.
Ni Frost ni Dubnau, que juntos han resumido recientemente este campo para el Annual Review of Neuroscience, creen que los fármacos antirretrovirales por sí solos sean la solución al alzhéimer o la ELA provocados por transposones. Como señala Douville, los fármacos se diseñaron para actuar solo sobre enzimas diana específicas: no harán nada con otros genes, ARN o proteínas de retrotransposones, que también podrían estimular la inflamación dañina para los nervios.
Mientras tanto, los científicos miran más allá de la ELA y el alzhéimer a medida que se acumulan pruebas de que los retrotransposones pueden contribuir a otras afecciones neurodegenerativas e inflamatorias, como la enfermedad de Parkinson y la esclerosis múltiple.
“Se está acelerando mucho”, afirma Frost.
Artículo traducido por Debbie Ponchner
10.1146/knowable-071425-1
Apoye a la revista Knowable
Ayúdenos a hacer que el conocimiento científico sea accesible para todos
DONAREXPLORE MÁS | Lea artículos científicos relacionados