Fármacos radiactivos atacan al cáncer con precisión
Los radiofármacos buscadores de tumores marcan un nuevo rumbo en oncología y prometen tratamientos específicos con menos efectos secundarios.
Manténgase informado
Suscríbase al boletín de noticias de Knowable en español
Un miércoles por la mañana a finales de enero de 1896, en una pequeña fábrica de bombillas de luz de Chicago, una mujer de mediana edad llamada Rose Lee se encontraba en el centro de un proyecto médico innovador. Con un tubo de rayos X colocado sobre el tumor en su seno izquierdo, Lee fue tratada con un torrente de partículas de alta energía que penetraron en la masa maligna.
“Y así”, como escribió más tarde su médico tratante, “sin el sonido de trompetas ni el redoble de tambores, nació la terapia con rayos X”.
La radioterapia ha avanzado mucho desde aquellos comienzos tempranos. El descubrimiento del radio y otros metales radiactivos abrió las puertas a la administración de dosis más altas de radiación para atacar cánceres ubicados más profundamente en el cuerpo. Más tarde, la introducción de la terapia de protones hizo posible guiar con precisión los haces de radiación hacia los tumores, reduciendo así el daño a los tejidos sanos circundantes —un grado de precisión que se perfeccionó aún más gracias a mejoras en la física médica, las tecnologías informáticas y las técnicas de imágenes de última generación—.
Pero no fue hasta el nuevo milenio, con la llegada de los radiofármacos con objetivos específicos, que este campo alcanzó un nuevo nivel de precisión molecular. Estos agentes, similares a misiles buscadores de calor programados para cazar el cáncer, viajan a través del torrente sanguíneo para lanzar sus ojivas radiactivas directamente al sitio del tumor.

El uso de radiación para matar células cancerosas tiene una larga historia. En esta foto de 1915, una mujer recibe “roentgenterapia” —tratamiento con rayos X— dirigida a un cáncer de células epiteliales en su rostro.
CRÉDITO: WIKIMEDIA COMMONS
En la actualidad, solo un puñado de estas terapias están disponibles de manera comercial para los pacientes —específicamente, para formas de cáncer de próstata y para tumores que se originan en las células productoras de hormonas del páncreas y el tracto gastrointestinal—. Pero esta cifra está por aumentar a medida que los principales actores de la industria biofarmacéutica comiencen a invertir fuertemente en la tecnología.
AstraZeneca se convirtió en el último peso pesado en unirse al campo cuando, el 4 de junio, completó la compra de Fusion Pharmaceuticals, fabricante de radiofármacos de nueva generación, en un acuerdo valorado en unos 2.400 millones de dólares. La iniciativa sigue a transacciones similares de más de 1.000 millones de dólares realizadas en los últimos meses por Bristol Myers Squibb (BMS) y Eli Lilly, junto con adquisiciones anteriores de empresas radiofarmacéuticas innovadoras por parte de Novartis, que continuó su racha —iniciada en 2018— con otra compra estimada en 1.000 millones de dólares para una nueva empresa de radiofarmacéuticos, como se reveló en mayo.
“Es increíble cómo, de repente, está de moda”, dice George Sgouros, físico radiológico de la Facultad de Medicina de la Universidad Johns Hopkins, en Baltimore, y fundador de Rapid, una empresa con sede en esa ciudad que ofrece software y servicios de imágenes para respaldar el desarrollo de radiofármacos. Este auge, señala, subraya un reconocimiento más amplio de que los radiofármacos ofrecen “una forma fundamentalmente diferente de tratar el cáncer”.
No obstante, tratar el cáncer de manera distinta significa navegar por un campo minado de desafíos únicos, en particular en la fabricación y distribución meticulosamente programada de estas nuevas terapias antes de que decaiga la radiactividad. Ampliar el alcance de la terapia para tratar una gama más variada de cánceres también requerirá aprovechar nuevos tipos de partículas que destruyen tumores y encontrar objetivos adecuados adicionales.
“Hay mucho potencial aquí”, dice David Nierengarten, analista que cubre el campo de los radiofármacos para Wedbush Securities en San Francisco. Pero añade que “todavía hay mucho margen para mejorar”.
Avances atómicos
Durante décadas, una forma radiactiva de yodo fue el único radiofármaco disponible en el mercado. Una vez ingerido, este yodo es absorbido por la tiroides, donde ayuda a destruir las células cancerosas de esa glándula con forma de mariposa ubicada en el cuello —una técnica de tratamiento establecida en los años cuarenta que sigue siendo de uso común en la actualidad—.
Pero la naturaleza dirigida de esta estrategia no es ampliamente aplicable a otros tipos de tumores.
La tiroides tiene una tendencia natural a absorber yodo del torrente sanguíneo, pues este mineral, que se halla en su forma no radiactiva en muchos alimentos, es necesario para la síntesis de ciertas hormonas que produce la glándula.
Otros cánceres no tienen una afinidad comparable por los elementos radiactivos. Y así, en lugar de secuestrar las vías fisiológicas naturales, los investigadores han tenido que diseñar fármacos que sean capaces de reconocer y adherirse a proteínas específicas producidas por células tumorales. Luego, estos medicamentos se diseñan para que actúen como transportadores específicos, entregando isótopos radiactivos —átomos inestables que emiten energía nuclear— directo al sitio maligno.
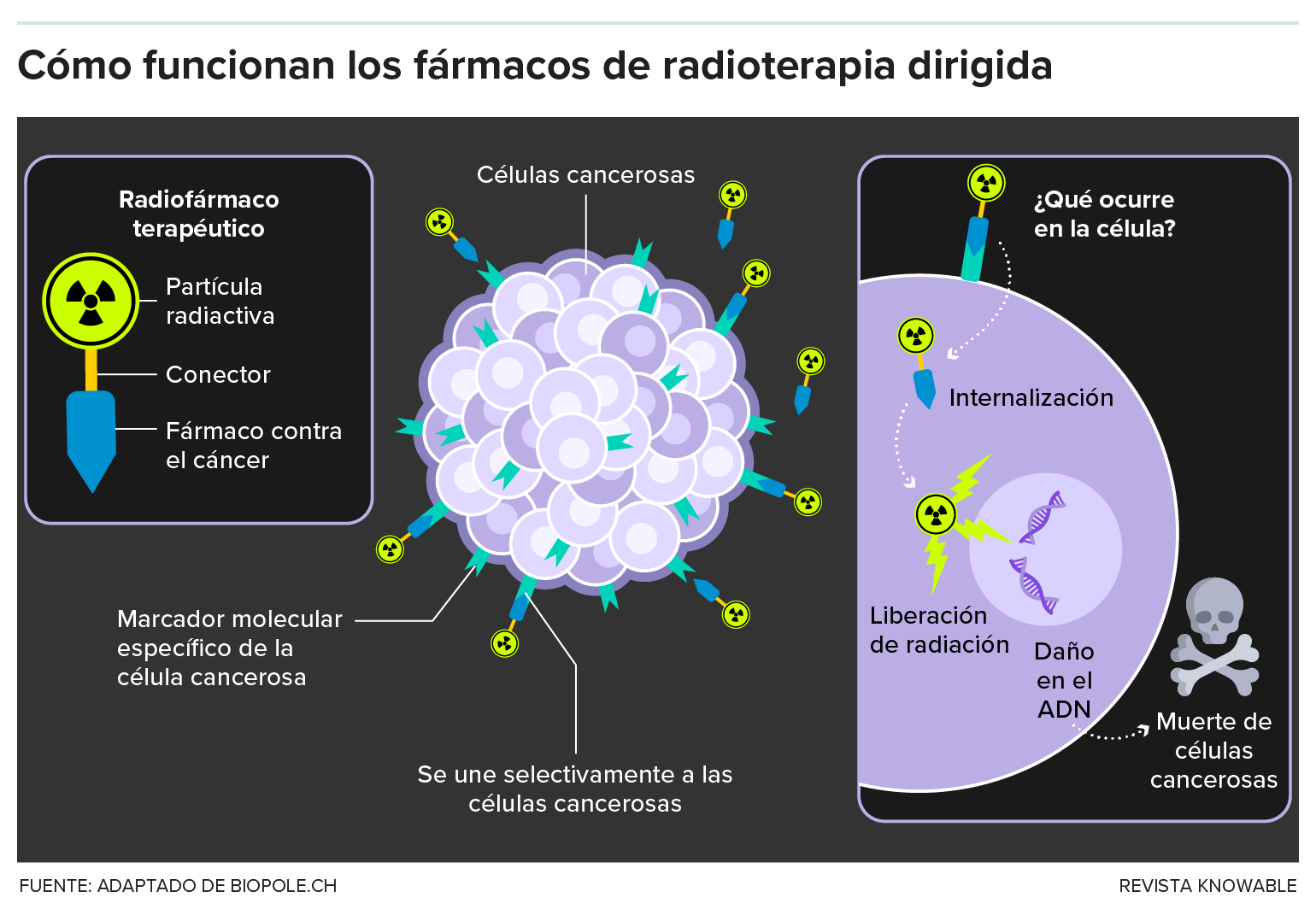
Este gráfico describe los conceptos básicos de los radiofármacos.
Los primeros agentes de este tipo que llegaron al mercado fueron estrictamente para obtener imágenes de tejidos dentro del cuerpo. Utilizando isótopos relativamente benignos y de vida corta, estos productos permitieron la iluminación precisa de tejidos cancerosos en estudios PET, ayudando a los médicos a diagnosticar y ubicar células malignas con mayor precisión. Esta innovación allanó el camino para la aparición de radiofármacos equipados con cargas radiactivas más potentes —y letales—, ahora con el objetivo no solo de obtener imágenes de células tumorales, sino también de matarlas.
Sin embargo, la estrategia tardó tiempo en establecerse en el tratamiento rutinario del cáncer
La primera terapia comercializada que combina isótopos radiactivos con una molécula dirigida a las células —un fármaco llamado Quadramet, aprobado por los reguladores estadounidenses en 1997— ofrecía un alivio paliativo para el dolor óseo causado por el cáncer, pero no estaba diseñada para reducir los tumores. Pocos médicos la prescribieron.
A principios de la década de 2000 surgieron dos nuevos fármacos para tratar el linfoma, ambos marcados con partículas radiactivas y dirigidos contra el CD20, un marcador de las células sanguíneas malignas. Aunque estos fármacos funcionaron muy bien en los ensayos clínicos, ayudando a reducir los tumores en una abrumadora mayoría de los participantes en los estudios, tuvieron dificultades para conseguir una aceptación generalizada en la práctica clínica. Ninguno de los dos pudo competir con el rituximab, un medicamento no radiactivo de gran éxito de ventas que también actúa contra el CD20, por lo que finalmente dejaron de comercializarse. En la actualidad, ninguno de los dos está disponible para los pacientes.
Los radiofármacos ofrecen “una forma fundamentalmente diferente de tratar el cáncer”.
— GEORGE SGOUROS
Después de estos reveses comerciales, el interés por los radiofármacos disminuyó y se estancó la inversión en su desarrollo. “En aquella época, las empresas farmacéuticas no querían tocar los agentes radioactivos ni con un palo de tres metros —aunque el palo fuera de plomo—”, explica Neil H. Bander, fundador y director científico de Convergent Therapeutics, una startup dedicada a los radiofármacos con sede en Cambridge, Massachusetts. “El concepto de un fármaco radiactivo era anatema para ellos”.
Pero los esfuerzos en las universidades continuaron, incluso en la Weill Cornell Medicine en Nueva York, donde Bander —que pasó 40 años en la facultad de medicina y ahora es profesor emérito— comenzó a hacer ensayos con fármacos de anticuerpos radiomarcados para tratar el cáncer de próstata, a partir del año 2000.
Estos medicamentos fueron diseñados para unirse a una proteína receptora que se halla en la superficie de las células del cáncer de próstata, conocida como antígeno de membrana específico de la próstata (PSMA, por sus siglas en inglés). Una vez unidos, estas células los internalizan y entregan su carga radiactiva directamente al núcleo genético de las células tumorales. (Bander coescribió un artículo sobre esta y otras terapias basadas en PSMA en el Annual Review of Medicine en 2024).
Opciones nucleares
En ese tiempo, en Europa, los médicos estaban avanzando en el desarrollo de agentes radiomarcados dirigidos a otro objetivo: los receptores de somatostatina. Estas proteínas, que están presentes en cánceres raros del sistema neuroendocrino, median la señalización hormonal que puede impulsar el crecimiento tumoral. Investigadores descubrieron que moléculas que imitadoras de hormonas cargadas con isótopos radiactivos podían unirse a estos receptores y reducir los tumores.
Los médicos experimentaron con diferentes cargas radiactivas bajo protocolos de uso compasivo que permiten a los pacientes gravemente enfermos tener acceso a tratamientos experimentales, utilizando formas inestables de elementos como el itrio y el indio antes de fusionarse en gran medida alrededor de un isótopo de lutecio. Este metal de tierras raras se eligió por ser menos dañino para los riñones y tener una vida media más larga, lo que beneficiaba la fabricación y la logística. En una clínica de Bad Berka, Alemania, se trataron a más de mil pacientes a lo largo de una década, lo que mostró tasas de supervivencia extendidas en comparación con el tratamiento convencional.
Paralelamente, varias empresas farmacéuticas emergentes comenzaron a establecer las bases regulatorias para una aceptación más amplia. Una empresa francesa llamada Advanced Accelerator Applications (AAA) llevó un fármaco marcado con lutecio a través de ensayos aleatorios y, en 2017, dio a conocer que esta terapia ralentizó notablemente la progresión de los tumores intestinales en comparación con el estándar de atención existente. El fármaco, comercializado como Lutathera, rápidamente obtuvo la aprobación de los reguladores europeos y estadounidenses.
Fue entonces cuando Novartis tomó nota. Aunque el gigante farmacéutico suizo había incursionado en los radiofármacos en el pasado, en ese momento lo hizo de lleno. A las pocas semanas de que Lutathera obtuviera el visto bueno en Europa, Novartis rápidamente cerró un acuerdo para adquirir AAA por casi 4.000 millones de dólares. Un año después, incorporó una pequeña empresa de Indiana llamada Endocyte por más de 2.000 millones de dólares más.
“Fue como si alguien hubiera accionado un interruptor”, dice Bander. El revitalizado interés de la industria por los radiofármacos se había acelerado de repente.

Los fármacos de radioterapia requieren un embalaje especial dentro de contenedores de plomo y cajas forradas, y una entrega rápida y precisa a los sitios donde se utilizarán como tratamiento.
CRÉDITO: NOVARTIS
La adquisición de Endocyte trajo un agente dirigido al PSMA que resultaría ser una verdadera revolución —tanto para los pacientes con ciertos casos de cáncer de próstata avanzado y difíciles de tratar, como para las ganancias de Novartis—.
Un ensayo clínico aleatorio encontró que cuando el medicamento se agregó a la atención estándar duplicó con creces el tiempo promedio antes de la progresión de la enfermedad —de menos de cuatro meses a más de ocho— y también extendió la esperanza de vida de los receptores en varios meses.
Debe destacarse que Lutathera también había mostrado una eficacia clínica impresionante. Pero los tumores neuroendocrinos son raros, y esta baja frecuencia significa que Lutathera nunca podría alcanzar el tan codiciado umbral de “éxito de taquilla” de generar mil millones de dólares en ventas por año. En comparación, el tratamiento de próstata dirigido a PSMA, aprobado en 2022 bajo la marca Pluvicto, combate una enfermedad tan común que aproximadamente uno de cada siete hombres recibirá ese diagnóstico durante su vida. Como tal, estuvo a solo 20 millones de dólares de alcanzar el estatus de éxito de taquilla menos de dos años después de su debut en el mercado.
Versión beta
Tanto Pluvicto como Lutathera se fabrican alrededor de pequeñas secuencias de proteínas, conocidas como péptidos. Estos péptidos se unen específicamente a receptores específicos en las células cancerosas —PSMA en el caso del cáncer de próstata y receptores de somatostatina en el caso de Lutathera— y administran radiación a través de la desintegración del lutecio inestable.
Infundidos en el torrente sanguíneo, estos medicamentos circulan por todo el cuerpo hasta que se adhieren firmemente a la superficie de las células tumorales que encuentran. Anclado en estos sitios objetivo, el isótopo de lutecio libera dos tipos de radiación que ayudan en el tratamiento del cáncer. La emisión primaria consiste en partículas beta, electrones de alta energía capaces de penetrar tumores y células circundantes, ingresar al ADN y causar daños que, en última instancia, desencadenan la muerte celular.
Los rayos gamma, también producidos en menores cantidades, no causan mucho daño a los tejidos pero permiten a los proveedores de atención médica rastrear en tiempo real dónde se distribuye el medicamento en el cuerpo. Esto ayuda a monitorear el progreso del tratamiento y ajustar las estrategias en consecuencia. “De hecho, puedes visualizar dónde va la dosis y tener una mejor comprensión”, dice Thomas Hope, especialista en medicina nuclear de la Universidad de California en San Francisco, quien fue consultor de RayzeBio (antes de su adquisición por parte de BMS a principios de este año), además de otros fabricantes de radiofármacos no mencionados en este artículo.
Muchas otras terapias que están actualmente en ensayos clínicos también utilizan lutecio radiactivo y otros isótopos emisores de beta. Pero los actuales esfuerzos de investigación y las importantes inversiones de la industria se están desplazando progresivamente hacia medicamentos que dependen de isótopos emisores de alfa.
En comparación con las partículas beta, las partículas alfa son más grandes y más energéticas. Esta característica les permite fragmentar el ADN rompiendo ambas hebras de la doble hélice, lo que lleva a una aniquilación celular altamente localizada. “Es básicamente como una bala de cañón que explota dentro de la célula”, dice John Valliant, fundador y director ejecutivo de Fusion Pharmaceuticals, una empresa canadiense cuyos radiofármacos emisores alfa fueron el atractivo de la reciente adquisición de la empresa por parte de AstraZeneca.
Otra ventaja clave de las partículas alfa es su limitada distancia de deplazamiento. Suelen penetrar solo entre 50 y 100 micrómetros —aproximadamente el ancho de un cabello humano—. Esto contrasta fuertemente con las partículas beta, que pueden atravesar milímetros de tejido antes de que se agote su energía. Como resultado, las terapias que emplean partículas alfa logran efectos altamente localizados: devastan el tejido tumoral y evitan lesiones a las células sanas cercanas.
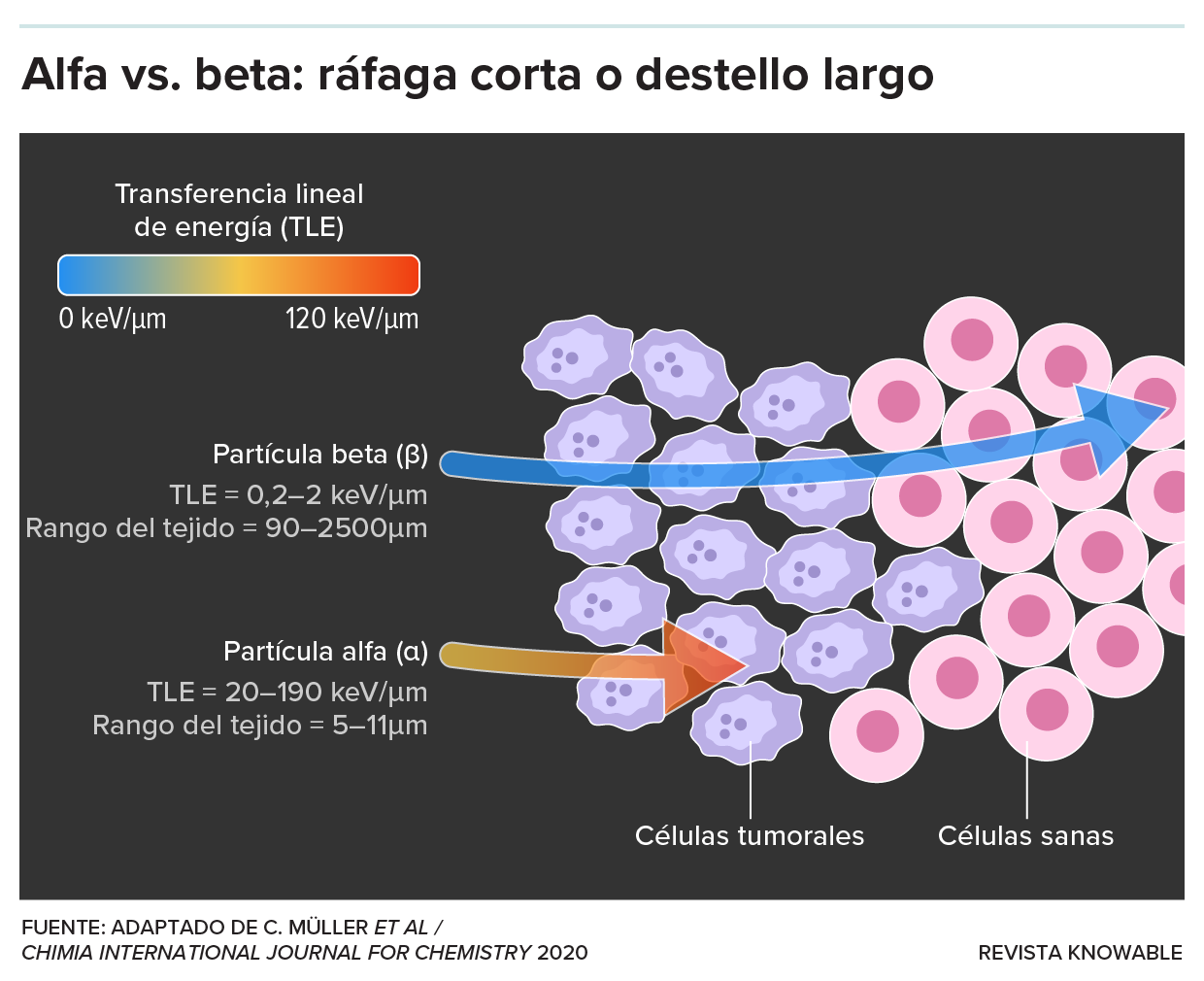
El interés por el uso de partículas alfa en radiofármacos está creciendo porque estas partículas pueden dirigirse con más precisión a los tejidos cancerosos, y tienen mayor capacidad para destruir células cancerosas de manera localizada.
La salida de los alfa
Algunos de los primeros radiofármacos emisores alfa que entren al mercado probablemente estarán dirigidos contra el cáncer de próstata a través del PSMA. Los desarrolladores son optimistas de que estos agentes eventualmente eclipsarán a Pluvicto, y están agregando características adicionales para mejorar la efectividad.
En Convergent, por ejemplo, Bander y su equipo están desarrollando un fármaco mucho más grande basado en un anticuerpo conectado a un isótopo liberador de alfa. Debido a su tamaño y complejidad, el fármaco permanece en el cuerpo mucho más tiempo que sus homólogos basados en péptidos, que tienden a ser eliminados rápidamente por los riñones. Eso significa más tiempo para que el fármaco encuentre su objetivo y mate las células tumorales. Además, los anticuerpos emisores alfa contra el PSMA parecen causar menos daño a las glándulas salivales en comparación con sus homólogos peptídicos, lo que proporciona un posible beneficio adicional en materia de seguridad.
Pero la destrucción celular precisa de los emisores alfa puede no ser siempre ventajosa, según Chris Behrenbruch, director ejecutivo de Telix Pharmaceuticals en el norte de Melbourne, Australia. La elección de la carga radiactiva, dice, debería estar influenciada por el estado de la enfermedad y por otras terapias que esté recibiendo el paciente a través de regímenes de medicamentos combinados que se están volviendo cada vez más estándar en la atención del cáncer.
Y a medida que los médicos comienzan a explorar el potencial de los tratamientos radiofarmacéuticos cuando se combinan con otros agentes que estimulan reacciones inmunitarias antitumorales, Behrenbruch propone que causar algún daño al tejido circundante podría en realidad ser deseable. Esto se debe a que el daño ayuda a atraer células T que combaten los tumores. “Nada molesta más al sistema inmunológico que la irradiación de tejido sano”, comenta.
“Todo el mundo está trabajando en nuevos objetivos”, señala. “¿Pero cuál de ellos será el ganador? No lo sabemos”.
— KEN HERRMANN
Telix ahora está explorando esta hipótesis, realizando ensayos clínicos que combinan un anticuerpo marcado con lutecio que se dirige a una enzima producida por células de cáncer de riñón con un fármaco de inmunoterapia diseñado para acelerar las células T del cuerpo. Al apuntar a un objetivo novedoso, el fármaco radiactivo de Telix también corre el riesgo de infligir daños colaterales, dado que las células sanas del estómago, el páncreas y la vesícula biliar —no solo las células cancerosas del riñón— también producen la enzima objetivo. Los datos de los ensayos iniciales indican que el tratamiento es, en general, tolerable, señala Behrenbruch. Aún así, se necesita investigación continua para evaluar de manera integral su perfil de seguridad.
El desafío de la especificidad —dirigir únicamente a las células cancerosas sin afectar el tejido sano— no es aislado para este caso. Más allá de los receptores de PSMA y somatostatina, el repertorio de proteínas expresadas de manera exclusiva o predominante por células tumorales es notablemente pequeño, señala Ken Herrmann, especialista en medicina nuclear del Hospital Universitario de Essen, en Alemania. Esta selección limitada complica el desarrollo de terapias que puedan atacar eficazmente los tumores sin imponer de forma accidental un daño indebido a los tejidos sanos circundantes, dice Herrmann, que asesora a la mayoría de las principales compañías farmacéuticas en el sector, además de varias empresas biotecnológicas más pequeñas.
“Todo el mundo está trabajando en nuevos objetivos”, señala. “¿Pero cuál de ellos será el ganador? No lo sabemos”.
Novartis está entre los líderes en la búsqueda competitiva para identificar los próximos objetivos revolucionarios. La compañía está buscando una nueva generación de medicamentos radiomarcados dirigidos contra varias proteínas prometedoras selectivas para el cáncer, algunas de las cuales ya están en evaluación clínica y otras en etapas anteriores de descubrimiento y validación. Al mismo tiempo, la empresa está ampliando sus capacidades de fabricación, con la apertura de nuevas instalaciones en todo el mundo diseñadas específicamente para la producción en masa de radiofármacos.
Y es que no es como fabricar otros tipos de medicamentos contra el cáncer. Los problemas en la cadena de suministro son comunes, como descubrió Bristol Myers Squibb a principios de junio cuando una escasez de isótopos obligó a la compañía a suspender temporalmente la inscripción de pacientes en la última etapa de un ensayo de un agente radiofarmacéutico adquirido recientemente de RayzeBio. Además, incluso cuando los isótopos necesarios están a la mano, la rápida desintegración del material radiactivo obliga a las empresas a operar dentro de un marco logístico único, con una coordinación meticulosa entre médicos y fabricantes para que los medicamentos lleguen a los hospitales dentro de períodos estrictamente definidos mientras las terapias siguen siendo potentes.
En general, las empresas tienen un período de planificación de dos semanas para producir un radioisótopo, adjuntarlo a un transportador de fármaco dirigido y enviar la terapia para su administración. No es exactamente una fabricación hecha a medida y por encargo. Pero tampoco es un producto disponible en el mercado. Está en algún punto intermedio, y cada dosis a menudo se administra “para un paciente específico en un momento específico y en un lugar específico”, señala Jeevan Virk, quien supervisa el desarrollo de fármacos radioterapéuticos en Novartis.
A principios de este año, Novartis inauguró una instalación de fabricación de 100 millones de dólares en Indianápolis, donde la compañía prevé producir cientos y posiblemente miles de dosis de Pluvicto todos los días. Está muy lejos de aquella rudimentaria fábrica de bombillas de luz en Chicago donde, a solo unas horas en auto, Rose Lee se convirtió en la primera paciente con cáncer tratada con rayos X. En estos sitios de innovación del Medio Oeste de los Estados Unidos, se proyecta la historia, conectando descubrimientos pasados con posibilidades futuras.
Artículo traducido por Daniela Hirschfeld
10.1146/knowable-082224-1
Apoye a la revista Knowable
Ayúdenos a hacer que el conocimiento científico sea accesible para todos
DONAREXPLORE MÁS | Lea artículos científicos relacionados