Cómo las células cancerosas viajan a nuevos tejidos y se afianzan en ellos
Comprender estas asombrosas migraciones a través del cuerpo humano, conocidas como metástasis, podría sugerir nuevos tratamientos.
Manténgase informado
Suscríbase al boletín de noticias de Knowable en español
En 2014, una mujer con cáncer avanzado cambió el rumbo de la vida científica de Adrienne Boire. El cáncer, que había comenzado en la mama, se había abierto camino hasta el líquido cefalorraquídeo de la paciente, dejando a esta mujer de mediana edad, madre de dos hijos, sin la capacidad de caminar. “¿Cuándo ocurrió esto?”, preguntaba desde la cama del hospital. “¿Por qué están creciendo allí las células?”.
¿En efecto, por qué? ¿Por qué emigrarían las células cancerosas al líquido cefalorraquídeo, lejos de donde habían nacido, y cómo se las arreglaron para prosperar en un líquido tan sorprendentemente pobre en nutrientes?
Boire, médica-científica del Memorial Sloan Kettering Cancer Center de Nueva York, decidió que esas preguntas merecían respuestas.
Las respuestas son urgentes, porque lo mismo que le ocurrió al paciente de Boire le está ocurriendo a un número cada vez mayor de enfermos de cáncer. A medida que ha mejorado la capacidad de tratar los tumores iniciales o primarios, la gente sobrevive a los primeros episodios de cáncer, pero años o décadas después reaparece, cuando el cáncer se ha instalado de algún modo en un nuevo tejido, como el cerebro, los pulmones o los huesos. Se trata del cáncer metastásico, que es la gran causa de muerte —aunque las cifras exactas son escasas, entre la mitad y la gran mayoría de las muertes por cáncer se atribuyen a la metástasis—. Para ofrecer a las personas más opciones y esperanzas será necesario comprender cómo esos cánceres consiguen migrar y recolonizarse.
La prevalencia de la metástasis oculta el arduo camino que deben recorrer las células cancerosas para conseguirla. Una célula que surge, por ejemplo, en la mama, está bien adaptada para vivir allí: para alimentarse de los ácidos grasos que tiene a su disposición, para resistir las amenazas locales y para crecer allí en un tumor sólido. Si consigue escapar al torrente sanguíneo, se encuentra viajando a una velocidad de hasta 40 centímetros por segundo con tensiones suficientes para desgarrarla. Si sobrevive a esa odisea y aterriza en un nuevo tejido —por ejemplo, el cerebro o el líquido cefalorraquídeo—, el entorno vuelve a ser totalmente distinto. Los alimentos a los que la célula está acostumbrada pueden estar ausentes; las células inmunitarias u otras moléculas ambientales nuevas pueden atacarla. Para una célula, realizar este viaje y adaptarse a un nuevo entorno es una tarea titánica.
“No es fácil ni trivial”, afirma Ana Gomes, bióloga oncológica del Moffitt Cancer Center de Tampa, Florida. “Esto va en contra de todo lo que es natural para estas células”.
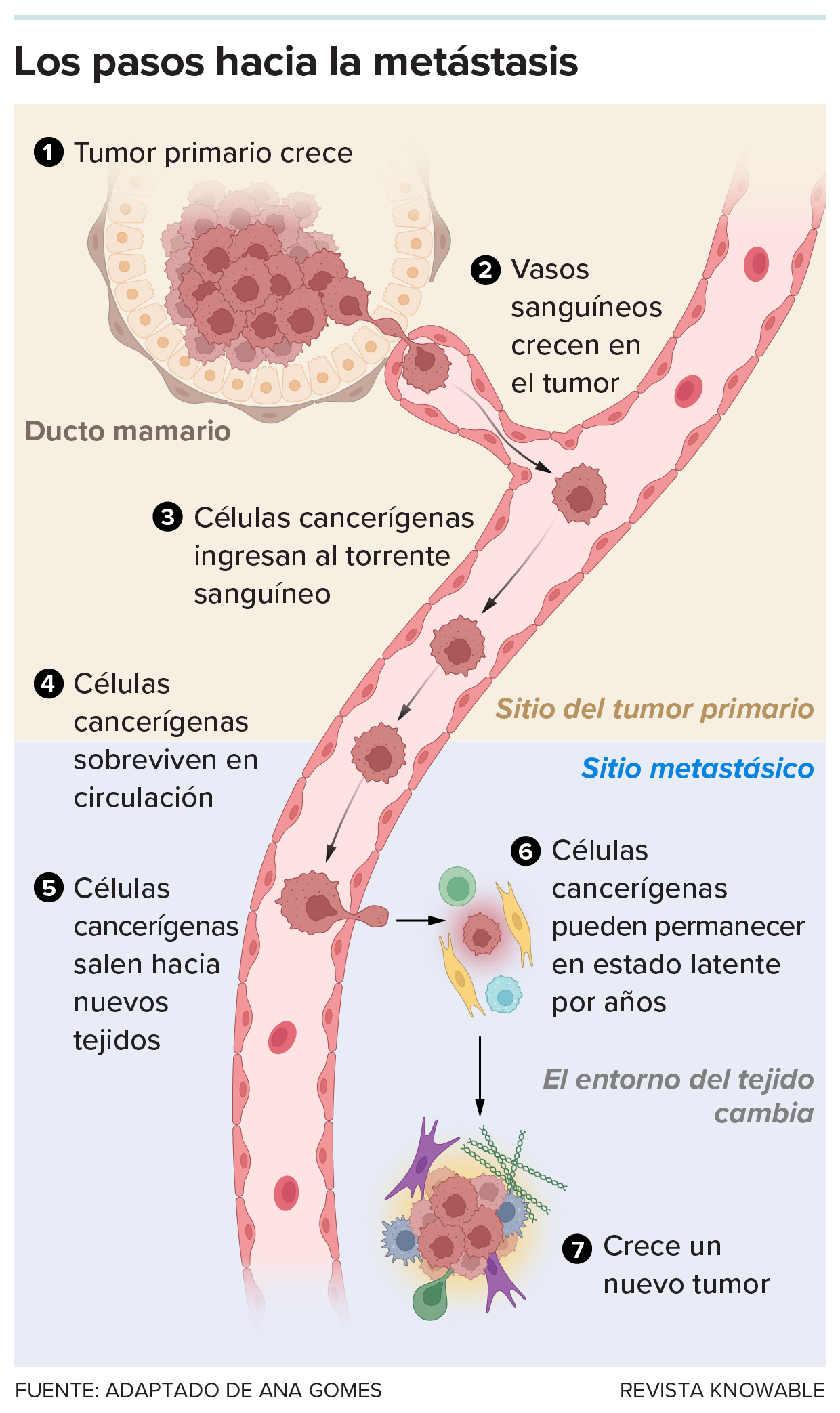
Trasladarse a un nuevo lugar y formar un nuevo tumor es un arduo viaje que pocas células pueden completar. Una célula debe salir del tumor inicial, sobrevivir al torrente sanguíneo y entrar en un nuevo tejido. Incluso entonces, la célula puede permanecer inactiva durante un tiempo, hasta que el entorno pueda favorecer su división y crecimiento para crear un nuevo tumor.
No es de extrañar que, aunque los tumores desprenden células con regularidad, la mayoría de las que se escapan perezcan o languidezcan sin llegar a establecerse como metástasis. “Personalmente, creo que la metástasis es un accidente”, afirma Matthew Vander Heiden, médico-científico y director del Instituto Koch de Investigación Integrativa del Cáncer del MIT. “Es muy, muy ineficiente”.
Las pocas células que consiguen esta hazaña son resistentes y flexibles en su forma de alimentarse y procesar las moléculas que las rodean. Pueden modificar su bioquímica para eludir peligros locales u obtener el combustible que necesitan en entornos escasos. Algunas incluso envían señales con antelación para modificar el órgano en el que aterrizarán, creando un cómodo nido con un suministro de alimentos listo para cuando lleguen. “Los cambios metabólicos ayudan a estas células a afrontar todos estos retos”, afirma Patricia Altea-Manzano, investigadora biomédica del Centro Andaluz de Biología Molecular y Medicina Regenerativa de Sevilla, España.
Estos hallazgos sugieren que las células metastásicas, al ser tan diferentes del tumor original, podrían ser vulnerables a nuevos tipos de tratamiento. Algún día los médicos podrían no tener que esperar a que la metástasis se consolide para bloquear o ralentizar la propagación del cáncer: “Es una gran oportunidad”, afirma Gomes.
Adaptaciones novedosas
Desde el punto de vista metabólico, no hay lugar como el hogar: los cánceres tienden a desarrollarse mejor en los tejidos donde crecen inicialmente, según ha demostrado el grupo de Vander Heiden. Y cuando se trasladan, estos tumores primarios tienen lugares de destino preferidos —los cánceres de próstata tienden a trasladarse a los huesos, por ejemplo—.
Sin embargo, algunas células aterrizarán en un lugar al que es muy improbable que lleguen a adaptarse: ciertos lugares, como el bazo y los músculos esqueléticos, parecen resistirse a la metástasis, y hay muchas razones posibles. Las células musculares, por ejemplo, consumen toneladas de energía, lo que provoca que sus mitocondrias liberen gran cantidad de un producto secundario del procesamiento energético: especies reactivas de oxígeno como el peróxido de hidrógeno. Estas moléculas de oxidación vigorosa son tóxicas, pero las células musculares locales pueden manejarlas. Sin embargo, aunque muchas células tumorales llegan al músculo esquelético a través de la sangre que lo alimenta copiosamente, rara vez se afianzan allí, bloqueadas, sospechan los investigadores, por esas moléculas reactivas de oxígeno.
Pero la adaptación a otros entornos novedosos es posible, como descubrió Vander Heiden cuando su grupo implantó células de cáncer de mama humano en la grasa mamaria o en los cerebros de ratones. Aunque el cerebro carece de los componentes básicos de la grasa —ácidos grasos— que las células del cáncer de mama están acostumbradas a ingerir, cuando las células se introdujeron en el cerebro, se adaptaron para fabricar sus propios ácidos grasos.
A continuación, los científicos trataron a los ratones con un fármaco que bloquea la síntesis de ácidos grasos: las células cancerosas del tejido cerebral crecieron a la mitad de velocidad (las células de la grasa mamaria siguieron creciendo sin inmutarse). Vander Heiden ha asesorado a empresas que se encuentran en las primeras fases de exploración de este enfoque como tratamiento.
A veces, los tumores pueden incluso preparar un lugar extraño para su llegada, en un proceso que algunos investigadores denominan “educación del nicho metastásico”. Los cánceres vierten a la sangre y la linfa no solo células, sino también hormonas, ADN y unas pequeñas burbujas de grasa llamadas vesículas. Estas burbujas pueden contener mensajes químicos, y cuando estas u otras señales llegan a órganos lejanos, pueden remodelar los tejidos según las especificaciones de las células tumorales. Según Gomes, esta “educación” ayuda a las células metastásicas a prosperar en un nuevo lugar.
Incluso los microbios pueden intervenir: en el caso del cáncer colorrectal, las bacterias del intestino enseñan al hígado a recibir células cancerosas metastásicas. Las bacterias intestinales colonizan el tumor intestinal y después atraviesan la barrera multicapa que normalmente mantiene el contenido intestinal alejado del resto del cuerpo. Entonces las bacterias pueden pasar al hígado, donde inducen la inflamación del órgano. Esto crea un entorno favorable al tumor, de modo que las células cancerosas que llegan más tarde pueden instalarse.
La conexión de los ácidos grasos
Altea-Manzano estudió este proceso de cebado durante su estancia como becaria postdoctoral con la bióloga del cáncer Sarah-Maria Fendt en el Centro de Biología del Cáncer VIB-KU Leuven en Bélgica. En este caso, eran los pulmones los que estaban siendo cebados por tumores que residían en otros lugares. Y al igual que observó Vander Heiden con la metástasis del cáncer de mama en el cerebro, el acceso a los ácidos grasos era un factor clave, en concreto al ácido graso palmitato, entre cuyas funciones se encuentran la de servir como fuente de energía y como componente de las membranas celulares.
Los pulmones ya están inundados de un material rico en grasa llamado surfactante, que recubre el interior de los pulmones y evita que el tejido se colapse. Cuando los investigadores alimentaron a ratones con una dieta rica en grasas, aumentaron los niveles de palmitato y otros ácidos grasos en los pulmones. Y cuando los investigadores inyectaron células de cáncer mamario en la sangre de esos ratones, la dieta rica en grasas provocó más del doble de metástasis en el pulmón.
Para comprobar si las células tumorales secretaban algo que preparara a los pulmones para albergarlas, Altea-Manzano y sus colegas cultivaron trozos de tumor mamario de ratón en una placa y luego recogieron el líquido que contenía todas las secreciones celulares. Cuando inyectaron esta sopa libre de células en ratones, aumentaron los niveles de palmitato en los pulmones; si además inyectaban células cancerosas, este tratamiento también incrementaba el nivel de metástasis pulmonares de esas células. Algún ingrediente fabricado por las células cancerosas cultivadas en esa placa de laboratorio estaba enviando un mensaje a los pulmones: produzca más palmitato. (Los científicos aún no están seguros de cuál es la sustancia señalizadora).
El resultado es que, si una célula de cáncer de mama aterriza en los pulmones, encuentra un festín graso listo para comer. Sin embargo, para aprovechar al máximo el nuevo menú, una célula de cáncer de mama recién llegada tendrá que alterar su química celular. Para ello, modifica sus mitocondrias para que puedan absorber más palmitato. En experimentos con ratones, el bloqueo de ese cambio interfirió en la metástasis, independientemente de la cantidad de palmitato presente. Podría ocurrir lo mismo en pacientes humanos, especula Altea-Manzano, coautora, junto con Fendt y otros, de un análisis de los cambios metabólicos que podrían promover o impedir la metástasis para el Annual Review of Cancer Biology de 2024.
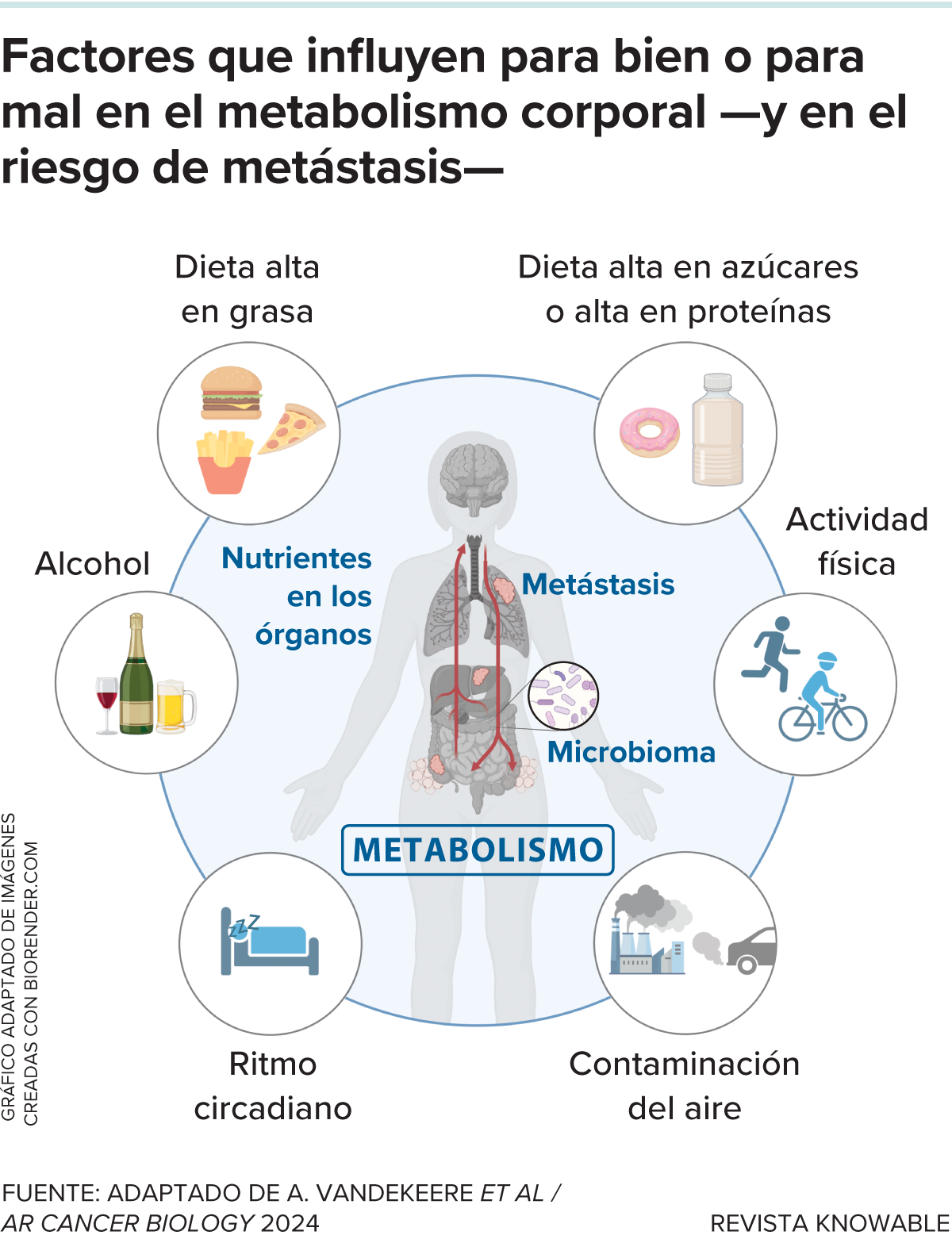
El estilo de vida de una persona, así como su entorno, pueden influir en su metabolismo y su microbioma. Eso, a su vez, puede ser un factor de éxito o fracaso en la metástasis del cáncer. Pero las relaciones son complejas: cosas que parecen buenas para el metabolismo a primera vista —como los antioxidantes— no siempre son cosas que contrarrestan directamente la propagación del cáncer.
Conocer al enemigo
Además de lugares ricos en grasa como los pulmones, los cánceres pueden adaptarse a lugares sorprendentemente difíciles, como el páramo estéril que es el líquido cefalorraquídeo que rodea el cerebro y la médula espinal.
La mayoría de los lugares del cuerpo donde se originan los tumores están repletos de nutrientes: grasas, aminoácidos, oxígeno, metales... todos los alimentos que necesita una célula en rápido crecimiento. En cambio, “el cerebro es una especie de princesa metabólica”, dice Boire. “Prefiere solo glucosa, por favor”.
No solo hay muy poco que comer, sino que las células cancerosas se encontrarán rodeadas de células de apoyo del sistema nervioso y células inmunitarias residentes, que arrojan agentes antitumorales.
El trabajo de Boire se centra en el líquido cefalorraquídeo. Se trata de un líquido transparente que carece de muchos nutrientes y, sin embargo, la metástasis en el líquido cefalorraquídeo se produce en entre el 5 % y el 10 % de los pacientes con tumores sólidos, y suele ser mortal en cuestión de meses. Para Boire, esto convierte a ese cáncer en “un digno adversario... Es totalmente malvado”.
Para saber cómo sobrevive una célula tan malvada, Boire y sus colegas examinaron las células metastásicas de cinco pacientes en los que los cánceres de mama o pulmón se habían apoderado del líquido cefalorraquídeo. Todas estas células habían puesto en marcha un sistema bioquímico que absorbe hierro, un metal necesario para producir energía y más componentes celulares. Como parte del sistema, las células segregaban una proteína llamada lipocalina-2 que recoge el escaso hierro del entorno; para la otra parte, fabricaban una proteína llamada transportador de hierro-lipocalina-2 que arrastra el complejo hierro-lipocalina-2 al interior de las células.
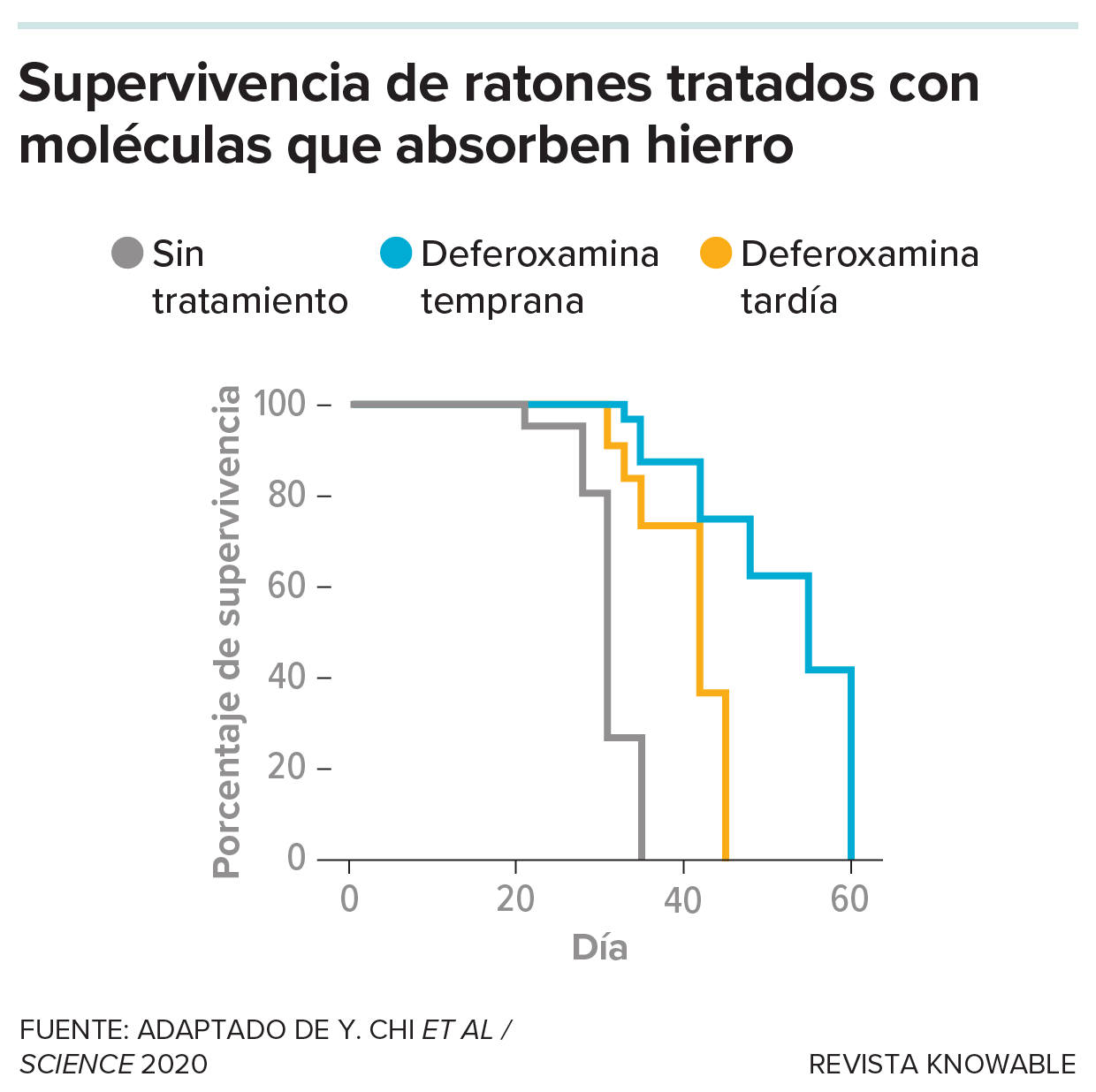
Los ratones estudiados como sistemas modelo de metástasis en el líquido cefalorraquídeo mueren normalmente en menos de 40 días. Pero cuando los científicos trataron a los ratones con un fármaco, la deferoxamina, que impide que el cáncer acceda al hierro, vivieron más tiempo.
Al estudiar el proceso en ratones, el equipo de Boire descubrió que las células cancerosas aumentan su acumulación de hierro en respuesta a las moléculas inflamatorias producidas por las células inmunitarias locales. A continuación, las células cancerosas absorben tanto hierro que las inmunitarias no pueden satisfacer sus propias necesidades de este metal. “Son como los originales glutones del bufé”, dice Boire. “Ya los conoces: se llevan todo lo que quieres y te dejan sin nada”.
Para matar de hambre a estos bichos celulares, los investigadores trataron a ratones con una molécula llamada deferoxamina que arrebata el hierro antes de que la lipocalina-2 tenga la oportunidad de agarrarlo. Efectivamente, los niveles de hierro en las células cancerosas disminuyeron. Además, los ratones sobrevivieron casi el doble que los animales que no recibieron el tratamiento.
Boire ha empezado a probar la deferoxamina en unas docenas de pacientes con cáncer metastásico en el líquido cefalorraquídeo y espera publicar pronto los resultados.
Señala que el tratamiento no actúa directamente sobre el cáncer, sino que cambia su entorno para que no pueda satisfacer sus necesidades. “Esto abre la puerta a la idea de que hay otras formas de combatir el crecimiento de las células cancerosas”, afirma.
Puntos de tensión
Además de alimento, las células cancerosas que viajan necesitan protección frente a los cambios que sufre su metabolismo en los nuevos entornos. La propia metástasis parece hacer que las células cancerosas generen especies reactivas de oxígeno, que pueden matarlas desde dentro, afirma Sean Morrison, biólogo del cáncer del Centro Médico Southwestern de la Universidad de Texas, en Dallas.
Su equipo estudia este obstáculo a la metástasis inyectando células de melanoma humano en ratones. Los científicos pueden colocar las células justo debajo de la piel, donde deberían estar cómodas, o introducirlas en otros lugares, como el torrente sanguíneo o el bazo, para ver si consiguen la metástasis.
En la piel, las células del melanoma no experimentan mucho estrés oxidativo. Pero las células del melanoma en la sangre u otros órganos experimentan estrés por niveles más altos de moléculas reactivas de oxígeno. Morrison sugiere que los niveles más altos de hierro y oxígeno en lugares como la sangre impulsan cambios bioquímicos que producen estas moléculas peligrosas.
El estrés oxidativo mata a las células errantes del melanoma mediante un proceso denominado ferroptosis, en el que los ácidos grasos poliinsaturados de la membrana de la célula cancerosa reaccionan con el hierro. “Es como si se iniciara un incendio de grasa en las células cancerosas cuando intentan migrar”, afirma Morrison.
Pero algunas células de melanoma obtienen una defensa si recorren el sistema linfático del organismo antes de asentarse. En la linfa, sus membranas recogen ácidos grasos monoinsaturados que no pueden reaccionar con el hierro de la misma manera, lo que les ayuda a resistir la ferroptosis, reportaron los investigadores.
Pero eso no es todo. Los científicos descubrieron que las células de melanoma más eficaces en la metástasis modificaron su metabolismo. Como resultado, se atiborraban de una molécula llamada lactato en su entorno, y parecían utilizar este lactato para fabricar moléculas protectoras que combatían los oxidantes. Cuando los científicos bloquearon la capacidad de las células de melanoma para absorber este lactato, se redujo la enfermedad metastásica en los ratones.
En cambio, cuando trataron a los ratones con más antioxidantes, las células metastásicas tenían más probabilidades de sobrevivir en el torrente sanguíneo y otros órganos: en algunos ratones tratados, el número de células metastásicas que navegaban por el torrente sanguíneo se duplicó con creces.
Ese resultado, publicado en 2015, fue una gran sorpresa, dice Morrison: “La gente piensa que los antioxidantes son buenos para uno”. Pues bien, en sus ratones de laboratorio, los antioxidantes también eran buenos para las células cancerosas, realmente buenos. El Washington Post calificó el estudio de “aterrador”, “provocador” y “alarmante”.
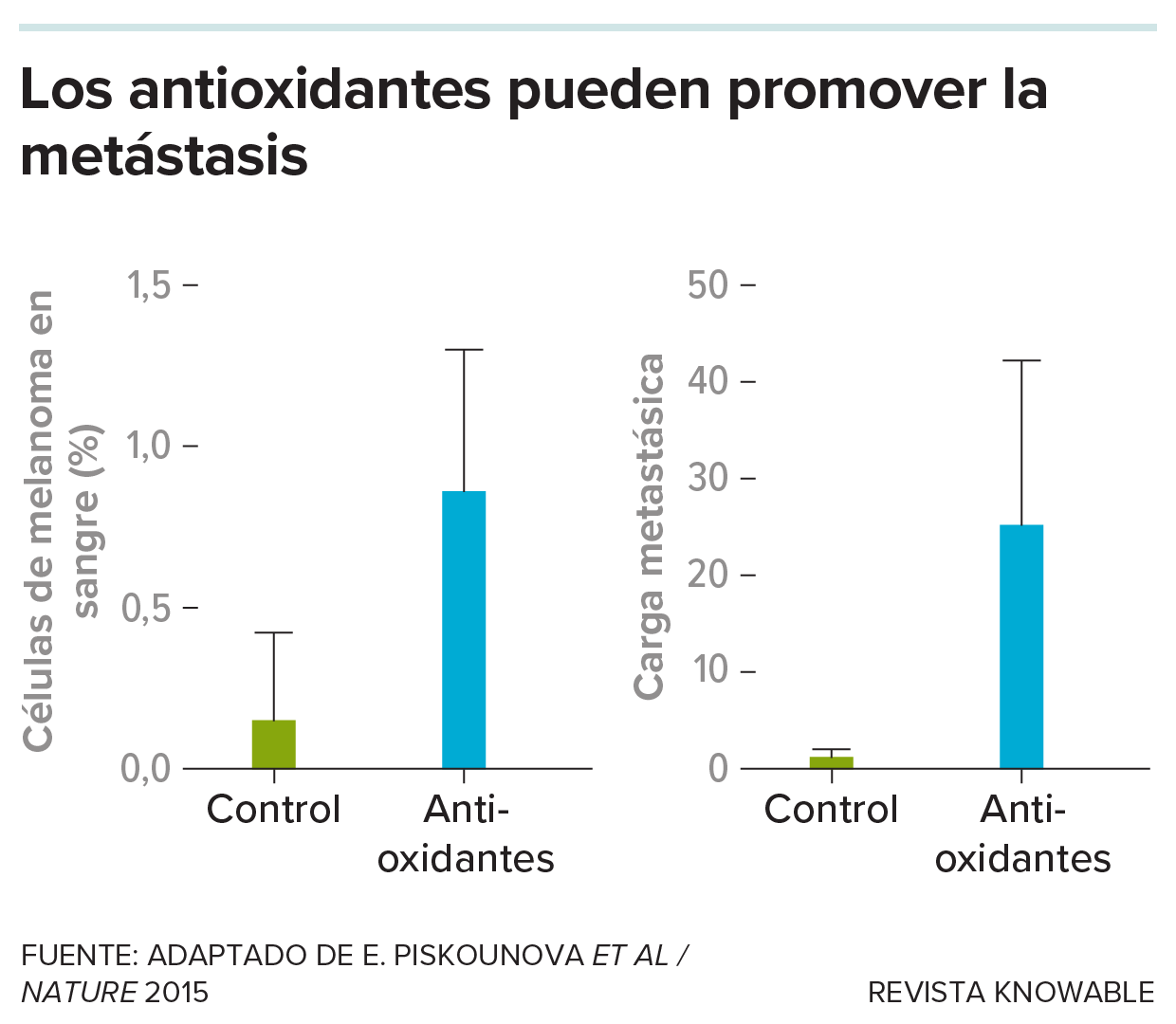
En un experimento, los científicos estudiaron una línea de ratones a los que se había inyectado un melanoma bajo la piel. El tratamiento con un antioxidante aumentó en gran medida la fracción de células en sangre que eran células metastásicas de melanoma (izquierda), así como la carga —cantidad— de células cancerosas metastásicas en sus órganos internos (derecha).
Pero los resultados coinciden con ensayos anteriores sobre antioxidantes en pacientes con cáncer. En estudios realizados a lo largo de décadas, antioxidantes como el betacaroteno y la vitamina E se relacionaron con mayores tasas de cáncer de pulmón y muertes en fumadores y mayores tasas de cáncer de próstata en hombres sanos. Aunque esos estudios no se centraban en el cáncer metastásico, Morrison ve una conexión. “La realidad es que en ciertas fases clave de la evolución del cáncer, las células cancerosas están solo al borde de la muerte por estrés oxidativo, por lo que se benefician más de los antioxidantes que las células normales”, especula.
Si los antioxidantes son buenos para el cáncer, el aumento de las moléculas reactivas de oxígeno podría combatir algunos tipos de metástasis. De hecho, algunos tratamientos actuales contra el cáncer amplifican las moléculas reactivas de oxígeno para eliminarlas.
Estos resultados implican que las opciones dietéticas o los suplementos podrían influir en el riesgo de cáncer y metástasis. Por ejemplo, Morrison especula con la posibilidad de que una dieta rica en ácidos grasos poliinsaturados provoque una mayor presencia de estos ácidos grasos favorables a la ferroptosis en las membranas de las células cancerosas. Si las células ya son bastante vulnerables, un poco de grasa poliinsaturada podría ser otra forma de empujarlas hacia la muerte celular. Esa es una dieta fácil de digerir: Morrison sugiere que uno de los platos del menú podría ser el salmón cocinado en aceite de soya.
Los cambios en la dieta no van a vencer al cáncer por sí solos, afirma Fendt. Pero, añade, podría ralentizar la progresión o ayudar a que otros tratamientos funcionen, aunque, como ilustran los ensayos con antioxidantes, los efectos de la dieta pueden ser difíciles de predecir.
“Es importante contar con una ciencia realmente sólida y rigurosa sobre estas cuestiones”, advierte Fendt. Hay algunos ensayos en marcha, pero, por ahora, no hay ninguna dieta “antimetástasis” que recetar.
Artículo traducido por Debbie Ponchner
10.1146/knowable-042925-1
Apoye a la revista Knowable
Ayúdenos a hacer que el conocimiento científico sea accesible para todos
DONAREXPLORE MÁS | Lea artículos científicos relacionados