¿De dónde vinieron todas esas estructuras dentro de las células complejas?
Los científicos coinciden en que hace eones, una bacteria se instaló dentro de otra célula y se convirtió en su centro de energía, la mitocondria. Pero existen teorías contrapuestas sobre el nacimiento de otros organelos como el núcleo y el retículo endoplásmico.
Manténgase informado
Suscríbase al boletín de noticias de Knowable en español
Hace más de 1.500 millones de años ocurrió algo trascendental: dos células pequeñas y primitivas se convirtieron en una. Quizás más que cualquier acontecimiento —excepto el origen de la vida en sí misma—, esta fusión cambió de forma radical el curso de la evolución en nuestro planeta.
Una célula terminó dentro de la otra y evolucionó hasta convertirse en una estructura que los escolares aprenden a describir como “la central eléctrica de la célula”: la mitocondria. Esta nueva estructura proporcionó una tremenda ventaja energética a su anfitrión —una condición previa para la evolución posterior de la vida multicelular compleja—.
Pero eso es solo una parte de la historia. La mitocondria no es la única estructura importante dentro de las células eucariotas complejas. Está el núcleo rodeado de membrana, guardián del genoma. Hay todo un sistema de membranas internas: el retículo endoplásmico, el aparato de Golgi, lisosomas, peroxisomas y vacuolas —esenciales para producir, transportar y reciclar proteínas y otros elementos dentro y alrededor de la célula—.
¿De dónde vinieron todas esas estructuras? Con acontecimientos perdidos en el pasado lejano y pocos rastros que sirvan como pistas evolutivas, esta es una cuestión muy difícil de abordar. Los científicos han propuesto varias hipótesis, pero solo recientemente, con algunas herramientas y técnicas nuevas, los biólogos celulares han podido analizar los inicios de esta intrincada arquitectura y arrojar algo de luz sobre sus posibles orígenes.
Una fusión microbiana
La idea de que los eucariotas se originaron a partir de la fusión de dos células se remonta a más de 100 años, pero no fue aceptada ni conocida hasta los años sesenta, cuando la fallecida bióloga evolutiva Lynn Margulis postuló su teoría de la endosimbiosis. La mitocondria, dijo Margulis, probablemente se originó a partir de una clase de microorganismos conocidos como alfaproteobacterias, un grupo diverso que hoy incluye la bacteria responsable del tifus y otra importante para la ingeniería genética de las plantas, entre muchas otras.
No se sabía nada sobre la naturaleza de la célula huésped original. Los científicos propusieron que ya era bastante complicada, y tenía una variedad de estructuras de membrana en su interior. Una célula de este tipo habría sido capaz de engullir e ingerir cosas —una característica eucariota complicada y energéticamente costosa llamada fagocitosis—. Y así podría haber sido como la mitocondria llegó por primera vez al huésped.
Pero esa idea, llamada hipótesis de las “mitocondrias tardías”, no explica, para empezar, cómo o por qué la célula huésped se volvió compleja.
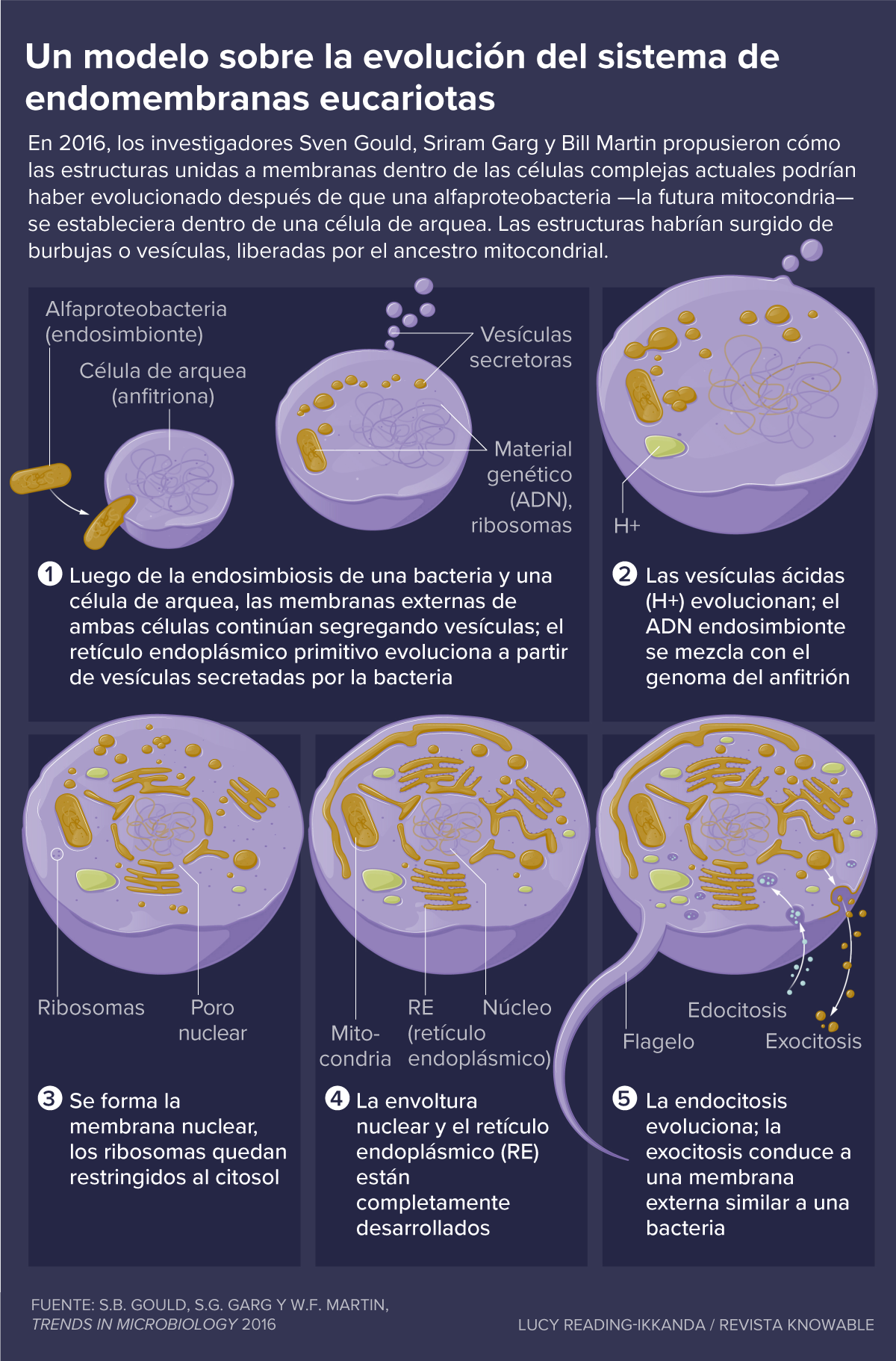
En 2016, el biólogo evolutivo Bill Martin, el biólogo celular Sven Gould y el bioinformático Sriram Garg, de la Universidad de Dusseldorf, en Alemania, propusieron un modelo muy diferente conocido como hipótesis de las “mitocondrias tempranas”. Argumentaron que, dado que en la actualidad ninguna célula primitiva tiene estructuras de membrana interna, parece muy poco probable que una célula las hubiera tenido hace más de 1.500 millones de años.
En cambio, razonaron los científicos, el sistema de endomembrana —toda la mezcolanza de partes que se ubican hoy dentro de las células complejas— podría haber evolucionado poco después de que la alfaproteobacteria se estableciera dentro de una célula huésped relativamente simple, de una clase llamada arquea. Las estructuras de la membrana habrían surgido de burbujas o vesículas liberadas por el ancestro mitocondrial.
Las bacterias de vida libre arrojan vesículas todo el tiempo, por todo tipo de razones, señalan Gould, Garg y Martin, por lo que parece razonable pensar que continuarían haciéndolo cuando estuvieran encerradas dentro de un huésped.
Eventualmente, estas vesículas se habrían especializado en las funciones que hoy desempeñan las estructuras de membrana dentro de las células eucariotas. Incluso se fusionarían con la membrana de la célula huésped, lo que ayudaría a explicar por qué la membrana plasmática de los eucariotas contiene lípidos con características bacterianas.
Las vesículas podrían haber cumplido una importante función inicial, afirma el bioquímico Dave Speijer, de la Universidad de Ámsterdam. El nuevo endosimbionte habría generado muchos químicos venenosos llamados especies reactivas de oxígeno, al oxidar ácidos grasos y quemarlos para obtener energía. “Estos (químicos) destruyen todo, son tóxicos, especialmente en el interior de una célula”, dice Speijer. Secuestrarlos dentro de vesículas habría ayudado a mantener la célula a salvo de daños, señala.
Otro problema creado por el nuevo huésped también podría haberse solucionado haciendo barreras de membrana, sugieren Gould, Garg y Martin. Después de la llegada de la alfaproteobacteria, fragmentos de su ADN se habrían mezclado con el genoma del huésped arqueal, interrumpiendo genes importantes. Reparar eso significaría desarrollar una maquinaria para empalmar estas piezas extrañas —hoy llamadas intrones— de las copias de ARN mensajero de los genes, de modo que no se confudan esas instrucciones para la producción de proteínas.
Pero eso creó otro problema. La maquinaria productora de proteínas —el ribosoma— funciona extremadamente rápido, uniendo varios aminoácidos por segundo. Al contrario, el sistema de eliminación de intrones de la célula es lento y elimina aproximadamente un intrón por minuto. Entonces, a menos que la célula pudiera mantener el ARNm alejado de los ribosomas hasta que el ARNm se procesara adecuadamente, la célula produciría muchas proteínas inútiles y sin sentido.
La membrana que rodea el núcleo ofreció una respuesta. Al funcionar como barrera espacial, permite que el empalme del ARNm termine en el núcleo antes de que el ARNm libre de intrones se traduzca en el líquido interno de la célula, el citosol. “Esta es la presión selectiva detrás del origen del núcleo”, explica Martin. Para formarlo, las vesículas secretadas por el endosimbionte se habrían achatado y envuelto alrededor del genoma, creando una barrera para mantener alejados a los ribosomas, pero aun permitiendo que las moléculas pequeñas pasaran libremente.
Una explicación de adentro hacia afuera
En resumen, la hipótesis de Gould, Garg y Martin explica por qué evolucionaron los compartimentos endomembranosos: para resolver los problemas creados por el nuevo huésped. Pero, para empezar, no explica completamente cómo llegó la alfaproteobacteria al interior del huésped, dice el biólogo celular Gautam Dey, del Laboratorio Europeo de Biología Molecular (EMBL, por sus siglas en inglés), en Heidelberg, Alemania; se supone que el endosimbionte ya está dentro. “Ese es un problema enorme”, dice Dey.
Una idea alternativa, propuesta en 2014 por el biólogo celular Buzz Baum, del University College London (con quien Dey trabajó alguna vez) y su primo, el biólogo evolutivo de la Universidad de Wisconsin, David Baum, es el modelo “de adentro hacia afuera”. En este escenario, la alfaproteobacteria y la arquea destinada a ser su eventual huésped habrían vivido juntas durante millones de años en una simbiosis íntima, dependiendo cada una de los productos metabólicos de la otra.
La célula arqueal habría tenido protuberancias largas, como se ve en algunas arqueas modernas que viven en estrecha asociación con otros microbios. La alfaproteobacteria se habría anidado en estas delgadas extensiones.
Con el tiempo, las protuberancias habrían envuelto a la alfaproteobacteria y la habrían encerrado por completo. Pero durante el largo período antes de que eso sucediera, la arquea habría iniciado cierta división espacial del trabajo: mantendría las tareas de procesamiento de información en su centro, donde estaba el genoma, mientras que funciones como la construcción de proteínas tendrían lugar en el citosol, entre las protuberancias.
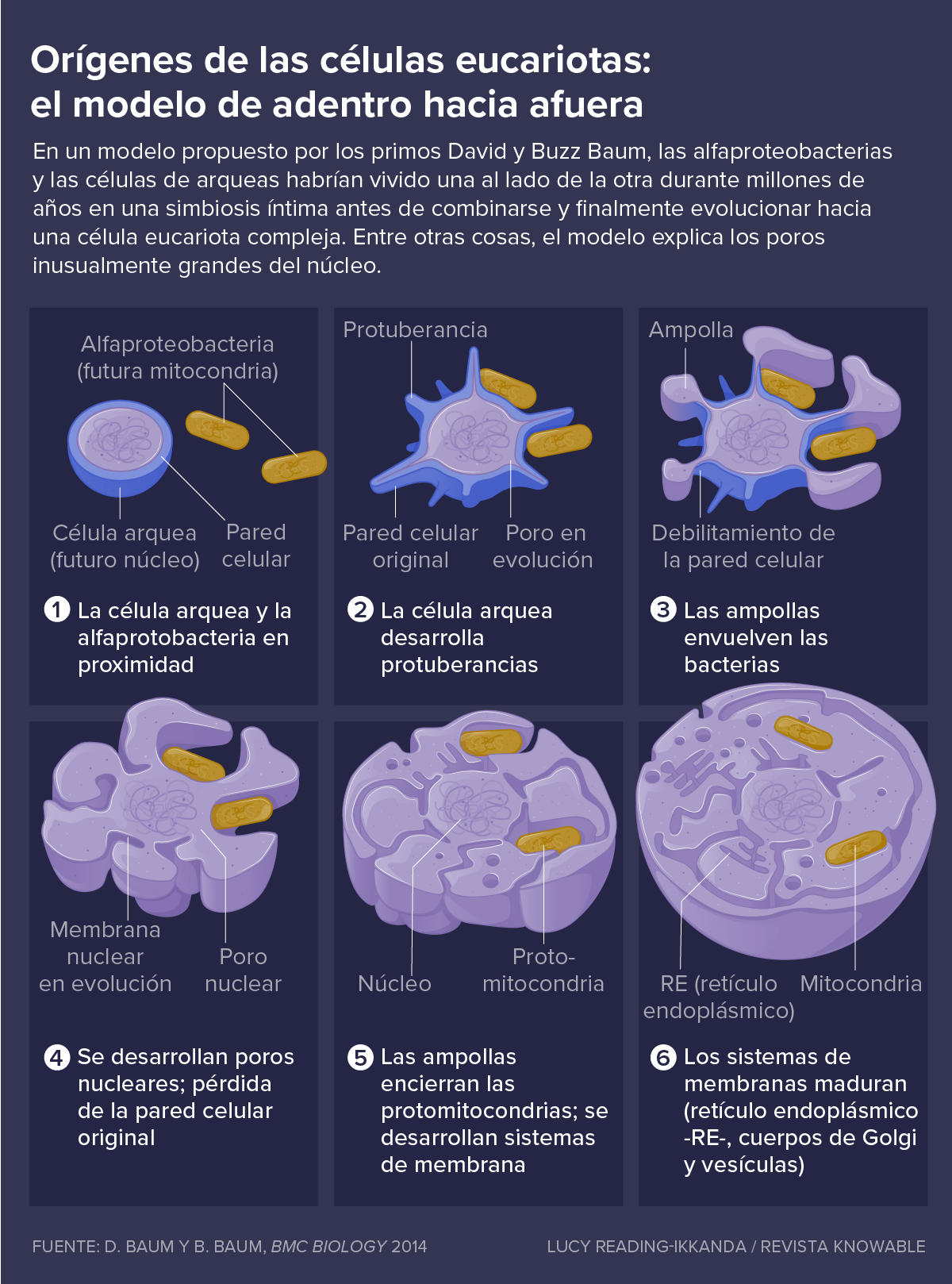
El poder del modelo de adentro hacia afuera, dice Buzz Baum, es que le da a la célula eones, antes de que la alfaproteobacteria quede completamente encerrada, para desarrollar maneras de regular la cantidad y tamaño de las mitocondrias y de otros compartimentos de la membrana que eventualmente se convertirían en internos. “Hasta que no puedas regularlos, estás muerto”, dice Buzz Baum.
El modelo también explica por qué el núcleo tiene la forma que tiene; en particular, ofrece una explicación sobre sus poros inusualmente grandes. Vistos desde el interior del centro de una célula arquea, las largas protuberancias serían aberturas que naturalmente podrían convertirse en grandes poros como esos, dice Baum.
Lo más importante es que el modelo de adentro hacia afuera explica cómo la alfaproteobacteria habría llegado al interior del huésped arqueal en primer lugar.
Aún así, el modelo de adentro hacia afuera tiene características que es necesario aclarar. Por ejemplo, la mitocondria terminaría en el lugar equivocado —dentro del retículo endoplásmico, la red de tubos en la que se ubican los ribosomas productores de proteínas de la célula—, mientras las protuberancias de las arqueas la envuelven. Y de ese modo se requeriría un paso adicional para llevar la alfaproteobacteria al citoplasma.
Pero la principal objeción de Martin es que este modelo no proporciona una presión evolutiva que hubiera causado el surgimiento inicial del núcleo u otros compartimentos rodeados de membranas. El modelo de adentro hacia afuera “está cabeza abajo y al revés”, subraya Martin.
El núcleo: un enigma en el medio
Aunque los modelos coinciden en que la mitocondria evolucionó a partir de una alfaproteobacteria, tienen ideas muy diferentes sobre el origen del núcleo y otros organelos.
En el modelo de Gould, Garg y Martin, la fuente de todas las estructuras habrían sido las vesículas liberadas por la mitocondria en evolución. Las vesículas para contener sustancias químicas reactivas o carga celular, y la capacidad de mover esta carga, habrían evolucionado muy temprano. El núcleo habría llegado más tarde.
En el modelo de adentro hacia afuera, el núcleo era, esencialmente, los restos de la célula arquea después de que envolvió sus membranas alrededor de la alfaproteobacteria. Entonces habría aparecido de inmediato. El retículo endoplásmico también se habría formado temprano, creado a partir de esas protuberancias apretujadas. Otros organelos habrían llegado más tarde —surgidos, según Buzz Baum, de brotes de la membrana de las arqueas—.
Por lo tanto, los modelos también hacen diferentes predicciones sobre la naturaleza química de las membranas de los organelos celulares —al menos originalmente— y cómo las células complejas actuales llegaron a tener lípidos de membrana que son todos químicamente similares a los de las bacterias, y no a los de las arqueas.
En el modelo de Gould, Garg y Martin, al principio todas las membranas excepto la más externa de la célula huésped habrían sido bacterianas, como las membranas del nuevo residente. Después, a medida que las vesículas bacterianas se fusionaron con esta membrana externa de las arqueas, los lípidos bacterianos reemplazarían lentamente a los de las arqueas.
Para empezar, en el modelo de adentro hacia afuera, las membranas del núcleo y del retículo endoplasmático —y probablemente otras— habrían sido arqueales, como el huésped. Solo más tarde, después de que los genes del genoma bacteriano se desplazaron hacia el genoma de las arqueas, los lípidos se volverían de naturaleza bacteriana, sugiere Baum.
¿Cómo probar estas ideas? A través de experimentos, los biólogos celulares están empezando a vislumbrar formas en que las vesículas simples podrían haberse diversificado en diferentes organelos con distintas funciones —adquiriendo varias formas, como las capas de membranas apiladas del retículo endoplásmico moderno o el cuerpo de Golgi, o terminando con distintas proteínas en su interior o en sus membranas—.
También destacan el dinamismo de la mitocondria moderna —y su potencial para engendrar nuevas estructuras de membrana—.
Tomemos, por ejemplo, el compartimento que Speijer cree que evolucionó tempranamente para lidiar con especies reactivas de oxígeno: el peroxisoma.
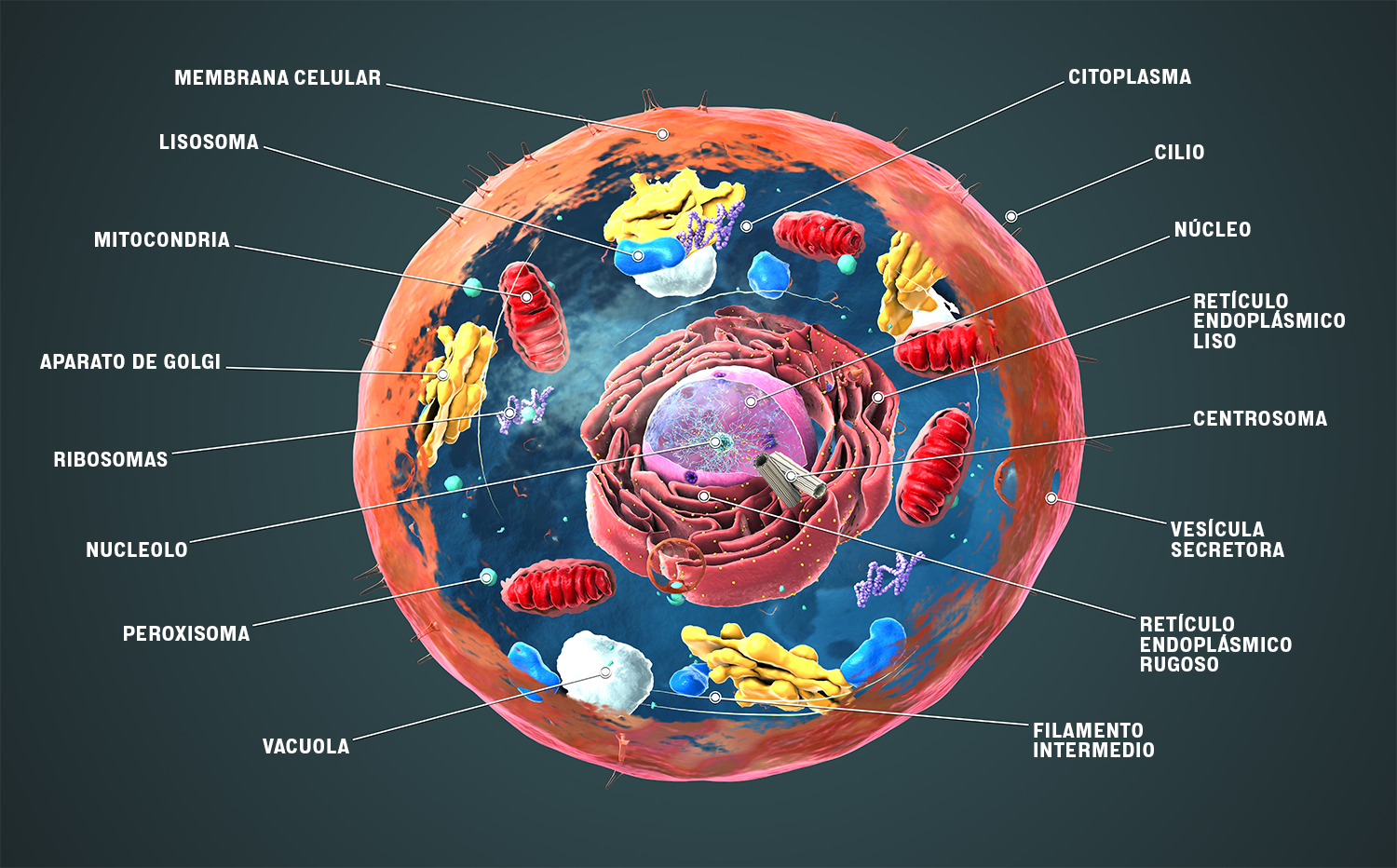
Las células eucariotas modernas tienen muchos compartimentos celulares especializados que realizan diferentes funciones. Esta especialización espacial y funcional las distingue de sus antepasados procarióticas.
CRÉDITO: ISTOCK.COM / CHRISTOPH BURGSTEDT
En 2017, la bióloga celular Heidi McBride, de la Universidad McGill de Montreal, informó que las células que carecían de peroxisomas podían generarlos desde cero. Trabajando con células de fibroblastos humanos mutantes sin peroxisomas, su equipo descubrió que estas células introducen dentro de las mitocondrias unas proteínas que son esenciales para la función de los peroxisomas. Luego, la membrana mitocondrial las liberó como pequeñas burbujas, o vesículas.
Estas vesículas, o protoperoxisomas, maduraron hasta convertirse en verdaderos peroxisomas cuando se fusionaron con otro tipo de vesículas derivadas del retículo endoplásmico, que transportan una tercera proteína necesaria para los peroxisomas. “Es un organelo híbrido”, dice McBride.
Para McBride, esto es una señal de que los peroxisomas —y probablemente otros organelos— originalmente vinieron de las mitocondrias (no solo del retículo endoplásmico, como se creía antes). “La presencia de mitocondrias inició la biogénesis de nuevos organelos”, agrega. “En el caso de los peroxisomas, es bastante directo”.
También se han observado otras excentricidades de las mitocondrias.
En primer lugar, un informe de 2021 del laboratorio del bioquímico Adam Hughes, en la Universidad de Utah, halló que cuando las células de levadura reciben cantidades tóxicas de aminoácidos, sus mitocondrias desprenden vesículas cargadas de moléculas transportadoras. Los transportadores mueven los aminoácidos hacia las vesículas, donde no envenenarán las mitocondrias.
Hughes también descubrió que las vesículas secretadas por las mitocondrias pueden formar largas extensiones similares a túbulos con múltiples capas, que recuerdan a las capas apiladas del retículo endoplásmico y el cuerpo de Golgi. Las estructuras persisten en la célula durante mucho tiempo. “Definitivamente, tienen su propia estructura única”, dice Hughes.
Y en 2022, la inmunóloga Lena Pernas, ahora en UCLA, demostró que las estructuras multicapa derivadas de mitocondrias también se pueden formar en otros contextos. Su equipo descubrió que cuando una célula es infectada por el parásito Toxoplasma, las mitocondrias rodean al parásito y cambian de forma. El parásito responde, y la consecuencia es que la mitocondria termina desprendiéndose de grandes trozos de membrana externa.
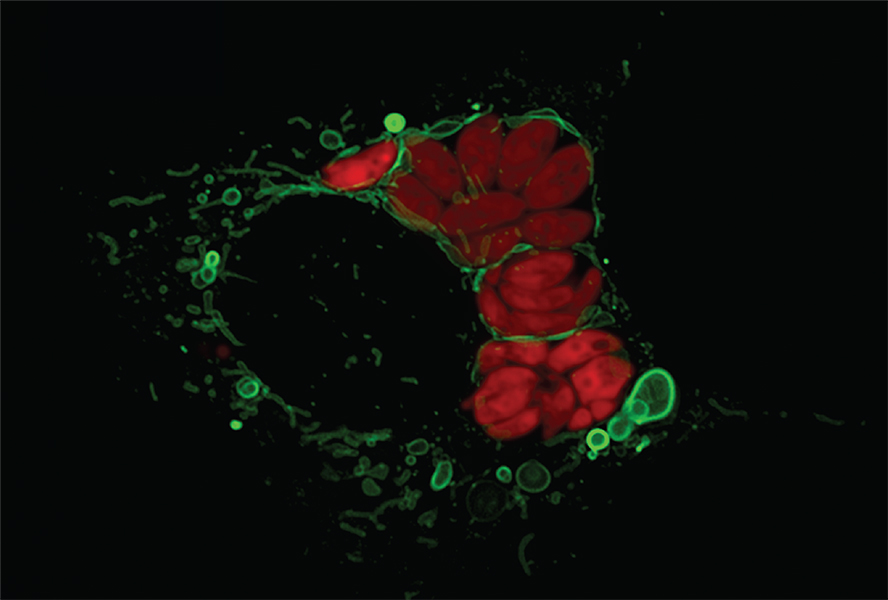
Esta imagen microscópica muestra lo que sucede cuando el parásito Toxoplasma gondii (en rojo) infecta una célula de ratón. Las mitocondrias de la célula (en verde) se agrupan alrededor del invasor y comienzan a desprender vesículas (burbujas verdes) hechas de membrana externa mitocondrial. A veces, las vesículas pueden formar estructuras elaboradas de varias capas. Observaciones como esta sugieren una forma en la que las diversas estructuras de endomembrana podrían haber evolucionado en una fase temprana de la evolución de los eucariotas.
CRÉDITO: LENA PERNAS
Pernas, que escribió sobre la remodelación mitocondrial en el Annual Review of Physiology de 2016, halló recientemente que estas estructuras, que inicialmente parecen vesículas simples, también pueden crecer y adoptar formas más complejas, como capas apiladas en forma de láminas. Más aún, el estrés de la infección cambia el tipo de proteínas que se coloca en estos trozos desprendidos de la membrana mitocondrial. Estos cambios abren la puerta a que las láminas apiladas se comporten de modos distintos a como lo harían normalmente, presentando la oportunidad de asumir nuevas tareas, señala Pernas.
A medida que Pernas y Hughes conocen más sobre estas estructuras —que se hallan en células y condiciones bastante diferentes—, más similares parecen. Es tentador, dice Hughes, imaginar cómo una estructura como esta, formada en los primeros días de la evolución de los eucariotas, podría haber evolucionado a lo largo de eones de selección natural hasta convertirse en algunos de los compartimentos de endomembrana que existen en las células actuales.
Quizás nunca sea posible saber con seguridad qué pasó hace tanto tiempo. Pero al explorar lo que puede suceder en las actuales células bacterianas, arqueas y eucariotas, los científicos pueden entender mejor lo que fue posible —e incluso probable—. Una célula se mueve hacia otra, lo que trae beneficios, pero también problemas, desencadenando una cascada compleja. Y luego, dice McBride, “todo florece y prospera”.
Artículo traducido por Daniela Hirschfeld
10.1146/knowable-010824-1
Apoye a la revista Knowable
Ayúdenos a hacer que el conocimiento científico sea accesible para todos
DONAREXPLORE MÁS | Lea artículos científicos relacionados