Los microscopios de superresolución muestran la vida interior de las células
Las técnicas avanzadas de microscopía óptica han alcanzado su madurez; y están proporcionando a los científicos una nueva comprensión de la biología humana y de lo que falla cuando enfermamos.
Manténgase informado
Suscríbase al boletín de noticias de Knowable en español
Utilizando un diminuto lente esférico de vidrio colocado entre dos placas de latón, el microscopista holandés del siglo XVII Antonie van Leeuwenhoek fue el primero en describir oficialmente los glóbulos rojos y los espermatozoides en los tejidos humanos, y en observar “animalculos” —bacterias y protistas— en el agua de un lago.
Microscopios ópticos cada vez más potentes le siguieron, que revelaron orgánulos celulares como el núcleo y las mitocondrias, productoras de energía. Pero en 1873, los científicos se dieron cuenta de que había un límite en el nivel de detalle. Cuando la luz pasa a través de un lente, se difunde por difracción. Esto significa que no se pueden distinguir dos objetos si están separados por menos de 250 nanómetros (250 milmillonésimas de metro) —por lo que se ven borrosos—. Esto impedía ver el funcionamiento interno de las estructuras celulares.
La microscopía electrónica, que utiliza haces de electrones en lugar de luz, ofrece una mayor resolución. Sin embargo, las imágenes en blanco y negro resultantes dificultan la distinción entre proteínas, y el método solo funciona en células muertas.
Sin embargo, ahora los ingenieros ópticos y los físicos han desarrollado sofisticados trucos para superar el límite de difracción de los microscopios ópticos, lo que abre un nuevo mundo de detalles. Estas técnicas de microscopía óptica de “superresolución” pueden distinguir objetos de hasta 100 nanómetros y, en ocasiones, incluso menos de 10 nanómetros. Los científicos adhieren diminutas etiquetas de colores fluorescentes a proteínas individuales o fragmentos de ADN, a menudo en células vivas, donde pueden observarlas en acción. Como resultado, ahora están llenando lagunas de conocimiento clave sobre cómo funcionan las células y qué falla en las enfermedades neurológicas y el cáncer, o durante las infecciones virales.
“Realmente podemos ver una nueva biología, cosas que esperábamos ver pero que no habíamos visto antes”, afirma Lothar Schermelleh, biólogo celular molecular que dirige un centro de imagen en la Universidad de Oxford, en el Reino Unido. Esto es parte de lo que los científicos están aprendiendo en esta nueva era de la microscopía óptica.
Superando el límite de difracción
La microscopía de superresolución utiliza diversas técnicas para detectar detalles que normalmente quedarían ocultos por el límite de difracción, explica Schermelleh. La microscopía de localización de moléculas individuales, por ejemplo, aprovecha el hecho de que los puntos de una imagen son más fáciles de localizar con precisión cuando aparecen aislados en lugar de agrupados. Los científicos etiquetan las moléculas de interés con marcadores fluorescentes diseñados para emitir luz espontáneamente. A medida que las sondas se encienden y apagan, los modelos computacionales estiman exactamente dónde se encuentra cada molécula —y reconstruyen una imagen de alta resolución de la muestra—.
Otra técnica, el agotamiento por emisión estimulada, escanea las muestras con láseres rodeados por un segundo anillo de láseres en forma de rosquilla que anulan la luz fluorescente alrededor del área de interés, agudizando la resolución del microscopio. Un tercer método, llamado microscopía de iluminación estructurada, ilumina las muestras con un patrón de rayas de luz. Estas rayas interfieren con la luz que emana de la muestra de manera que los científicos pueden inferir detalles adicionales sobre la imagen.
Los fundamentos de estas técnicas se desarrollaron a principios de la década de 2000, pero solo recientemente se han generalizado y se han vuelto lo suficientemente accesibles como para que los biólogos las utilicen de forma habitual, afirma Schermelleh. “Ahora tenemos muchos proyectos que utilizan la microscopía de superresolución como una herramienta genuina para el descubrimiento biológico”, afirma, “no solo para crear imágenes bonitas”.
Revisión de los libros de texto de biología
Estas técnicas ya han revelado nuevas estructuras celulares. Los científicos han descubierto que las neuronas tienen un tipo único de andamio, llamado esqueleto periódico asociado a la membrana, o MPS, por sus siglas en inglés, que proporciona rigidez y forma y ayuda a regular las señales que pasan de una neurona a otra y a mantener la función general de las células. “El MPS interviene en casi todas las funciones neuronales”, afirma el neurobiólogo de la Universidad de Columbia Victor Macarrón-Palacios, quien recientemente dio a conocer junto con sus colegas que una proteína concreta, la paralemmina-1, es responsable de organizar la intrincada estructura del MPS.
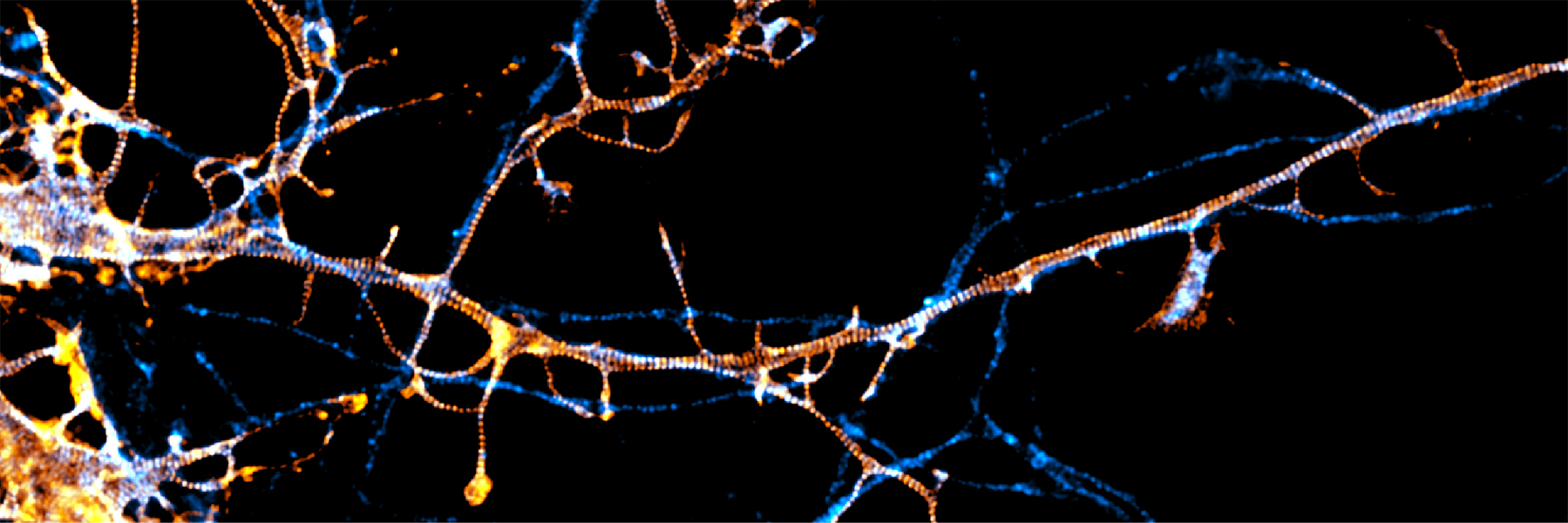
Técnicas especializadas de microscopía han revelado que las células nerviosas tienen un tipo especial de esqueleto interno llamado esqueleto periódico asociado a la membrana. La nanoarquitectura única de este esqueleto está regulada por una proteína llamada paralemmina-1 (marcada con fluorescencia en esta imagen).
CRÉDITO: VICTOR MACARRÓN-PALACIOS / MAX PLANCK INSTITUTE FOR MEDICAL RESEARCH
Otras estructuras celulares también resultan ser más complejas de lo que parecían. A principios de 2025, la biofísica Melike Lakadamyali, de la Universidad de Pensilvania, y sus colegas descubrieron que los orgánulos llamados lisosomas, cuya función según los libros de texto es descomponer los desechos de las células, pueden tener diferentes combinaciones de proteínas en su superficie. Esto probablemente esté relacionado con funciones adicionales que tienen lisosomas específicos, como detectar nutrientes y reparar membranas rotas.
Los científicos también han estado estudiando cómo interactúan los orgánulos entre sí. La bióloga celular Jennifer Lippincott-Schwartz, del Campus de Investigación Janelia del Instituto Médico Howard Hughes en Virginia, por ejemplo, está analizando las estructuras que utilizan las mitocondrias para acoplarse al retículo endoplásmico, que produce proteínas y suministra calcio y grasas a las mitocondrias.
Estos estudios podrían ayudar a revelar las causas de algunas enfermedades. El año pasado, Lippincott-Schwartz descubrió que las mutaciones en el gen VAPB, que se cree que contribuyen a la esclerosis lateral amiotrófica (ELA), una enfermedad que destruye los nervios, pueden interferir en la capacidad del retículo endoplásmico para conectarse con las mitocondrias. Esto podría alterar la función de estas centrales energéticas y ayudar a explicar cómo surge la ELA. “Solo estamos empezando a comprender qué hacen realmente a nivel celular estas diversas mutaciones genéticas que subyacen a algunas de estas enfermedades”.
Mirando dentro del ADN humano
Los científicos también han estado observando el núcleo y estudiando el ADN que contiene. El ADN humano, si se extrajera de una sola célula y se estirara, mediría casi dos metros. Para caber dentro del núcleo, se envuelve alrededor de proteínas llamadas histonas, creando una cadena de cuentas conocida como cromatina. La cromatina se enrolla y se retuerce aún más para formar nuestros cromosomas.
Los bucles y racimos de cromatina, o dominios, solo pueden estudiarse en detalle con microscopía de superresolución, por ejemplo, marcando segmentos de ADN con sondas fluorescentes, afirma Schermelleh, que ha estado estudiando cómo este material se organiza en 3D en las células de los mamíferos. “La escala de tamaño está justo por debajo del límite de difracción, por lo que antes no se podía evaluar”.
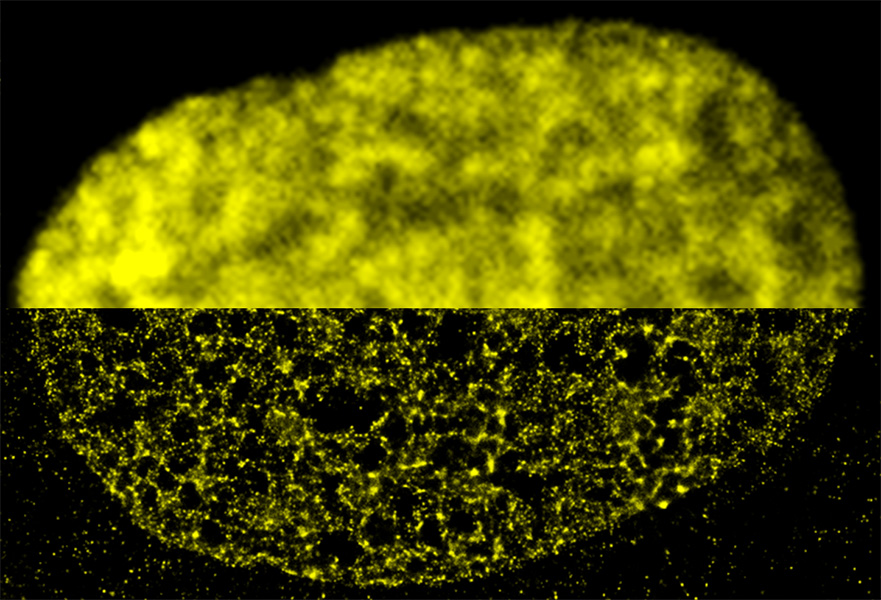
Dentro del núcleo de una célula fibroblástica, la proteína histona H2B, que se une al ADN, está marcada con fluorescencia amarilla. La mitad superior se fotografió con microscopía de fluorescencia de campo amplio convencional; la mitad inferior se fotografió con microscopía de superresolución.
CRÉDITO: M.A. RICCI ET AL / CELL 2015
Las investigaciones de Lakadamyali han revelado, por ejemplo, que las cadenas de ADN-histonas se organizan en estructuras mucho más variables de lo que los científicos habían supuesto, con algunas regiones de ADN más compactas que otras.
Este empaquetamiento determina la accesibilidad de una región determinada del ADN. Y eso es importante, porque las diferentes células del cuerpo, por ejemplo, las células del corazón o las neuronas, solo utilizan un subconjunto específico de sus genes. Los que utilizan se quedan en un estado más laxo y accesible, mientras que los silenciados se empaquetan de forma más compacta.
En 2015, Lakadamyali descubrió que las células madre embrionarias, que pueden desarrollarse en cualquier tipo de célula, tienen una estructura de cromatina muy laxa en comparación con las células más especializadas, que han silenciado los genes que no necesitan. “De hecho, podemos determinar si una célula es una célula madre o una célula diferenciada basándonos en la organización espacial de la cromatina”, afirma Lakadamyali, coautora de una revisión sobre técnicas de superresolución de 2023 publicada en el Annual Review of Biophysics.
Mejorando las terapias contra el cáncer
Los científicos también están examinando las células afectadas por enfermedades. Por ejemplo, el biofísico Markus Sauer, de la Universidad de Würzburg, Alemania, está estudiando ciertas proteínas receptoras de la superficie de las células cancerosas que se utilizan como dianas en terapias para destruir el cáncer. En el caso de los cánceres de sangre, por ejemplo, los científicos han modificado genéticamente células inmunitarias para que encuentren y destruyan las células cancerosas que tienen proteínas específicas en la superficie.
Pero las técnicas que se utilizan habitualmente para analizar las proteínas de las células cancerosas de los pacientes y emparejarlos con terapias eficaces no ofrecen una visión completa, afirma Sauer. Esto quedó demostrado en 2015, cuando los médicos descubrieron que podían tratar con éxito a pacientes con mieloma múltiple, un cáncer de la sangre, con terapias dirigidas a un receptor llamado CD19, a pesar de que el CD19 no se había detectado en las células cancerosas del mieloma múltiple con los métodos habituales.
Sauer y sus colegas descubrieron en 2019 que las proteínas CD19 eran claramente visibles con microscopía de superresolución. Aprendieron que, para realizar su trabajo destructivo, las terapias inmunológicas solo necesitan unas 10 proteínas CD19 entre los cientos o miles de otras proteínas presentes en la superficie de una célula cancerosa.
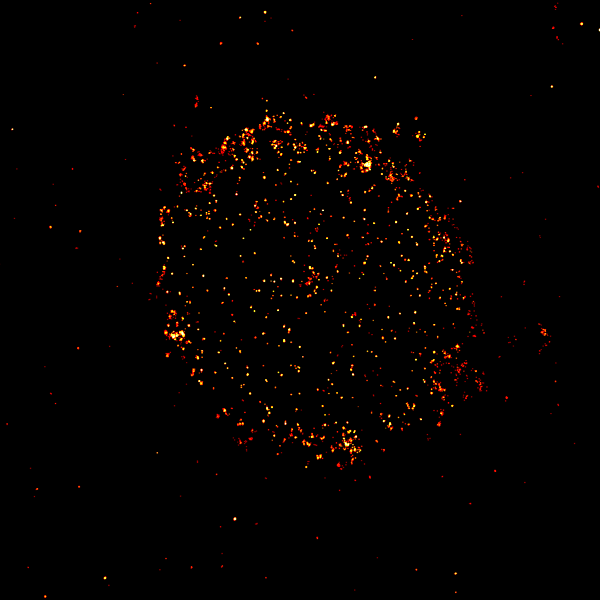
Las nuevas técnicas de microscopía que pueden iluminar las proteínas receptoras llamadas CD19 en la superficie de las células cancerosas (mostradas aquí) pueden determinar qué pacientes podrían beneficiarse de las terapias dirigidas al CD19. La imagen es de una célula de una persona con mieloma múltiple, un tipo de cáncer de la sangre.
CRÉDITO: MARKUS SAUER
Estas técnicas de microscopía pueden utilizarse para adaptar mejor los tratamientos eficaces a los pacientes, afirma Sauer. Sus investigaciones más recientes han identificado una nueva proteína receptora para las terapias y han ayudado a dilucidar el proceso exacto de destrucción de los tumores, un conocimiento que podría ayudar a mejorar la eficacia de las inmunoterapias. “Hay que visualizar esos procesos a nivel molecular”, afirma.
Filmar invasiones virales
También se están investigando los astutos trucos que utilizan los virus para infectar las células humanas y reproducirse. Comprender esta dinámica podría ayudar a los científicos a desarrollar nuevos medicamentos antivirales, afirma el virólogo Christian Sieben, del Centro Helmholtz para la Investigación de Infecciones de Alemania.
A principios de 2025, por ejemplo, Sieben dio a conocer cómo el virus de la gripe A infecta las células humanas. Mediante el marcado de proteínas virales y humanas, él y sus colegas observaron cómo el virus se adhería primero a proteínas receptoras individuales en la superficie celular. Luego, el virus esperaba hasta que otras proteínas receptoras, que se movían por la fluida membrana celular, se acumulaban cerca. Sieben y sus colegas descubrieron que solo cuando el virus se adhería a múltiples receptores podía entrar en la célula.
Y en 2024, un equipo de científicos de la Universidad de Stanford examinó cómo se replica el virus de la Covid-19 dentro de las células humanas. Utilizando marcadores fluorescentes para etiquetar el material genético del virus, el biofísico Leonid Andronov y sus colegas descubrieron que el SARS-CoV-2 crea una burbuja con una doble membrana en la que copia su material genético. Esto probablemente evita su destrucción por parte de la célula, afirma Andronov.
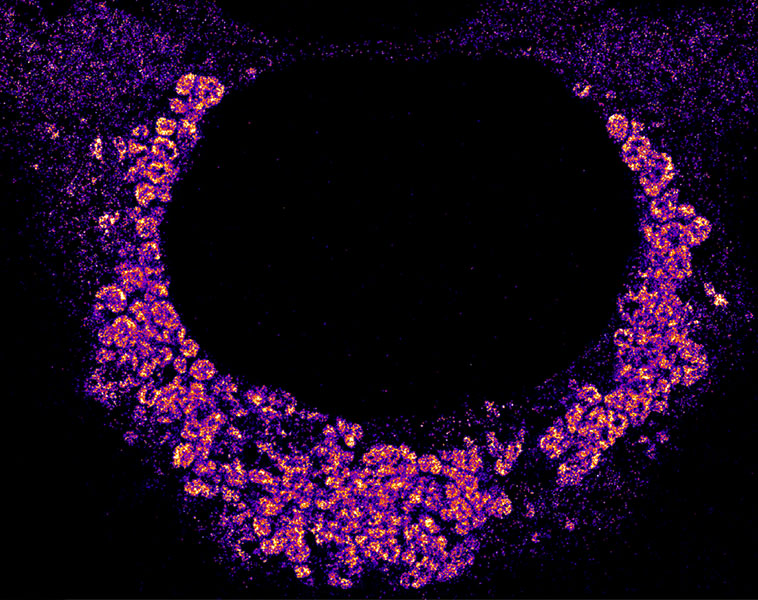
Cuando el virus de la Covid-19 se copia en las células humanas, se oculta del sistema inmunitario de la célula envolviéndose en burbujas de doble membrana, que se ven como agregados grumosos del material genético del virus marcado con fluorescencia. El núcleo de la célula aparece como un círculo oscuro en el centro.
CRÉDITO: L. ANDRONOV ET AL / NATURE COMMUNICATIONS 2024
A medida que más y más científicos utilizan la microscopía de superresolución para iluminar lo que ocurre dentro de las células, ¿cuántos más detalles pueden esperar ver? Según Lakadamyali, mejoras como la creación de sondas fluorescentes más pequeñas, que permiten marcar múltiples sitios a lo largo de una sola proteína, podrían aumentar aún más la resolución.
Quizás algún día los avances en superresolución puedan rivalizar con los de la microscopía electrónica. Después de todo, hace solo dos décadas, “no sabíamos que podíamos romper el límite de difracción”, afirma. “Hemos avanzado mucho en un periodo de 20 años. Creo que es posible”.
Artículo traducido por Debbie Ponchner
10.1146/knowable-081925-1
Apoye a la revista Knowable
Ayúdenos a hacer que el conocimiento científico sea accesible para todos
DONAREXPLORE MÁS | Lea artículos científicos relacionados