Todos somos mosaicos genéticos
Su cuerpo es una colección de células con miles de errores genéticos acumulados a lo largo de la vida —muchos inofensivos, otros dañinos y al menos unos pocos que pueden ser beneficiosos—.
Manténgase informado
Suscríbase al boletín de noticias de Knowable en español
Su inicio se dio cuando un óvulo y un espermatozoide se encontraron y el ADN de sus padres biológicos se unió. Su primera célula empezó a copiar el genoma recién fusionado y a dividirse para construir un cuerpo.
Y casi inmediatamente empezaron a acumularse errores genéticos.
“Ese proceso de acumulación de errores en el genoma continúa durante toda la vida”, dice Phil H. Jones, biólogo especializado en cáncer del Instituto Wellcome Sanger de Hinxton, en Inglaterra.
Los científicos saben desde hace tiempo que los sistemas de copia del ADN cometen errores ocasionales —así es como suelen empezar los cánceres—, pero solo en los últimos años la tecnología ha sido lo suficientemente sensible como para catalogar cada metedura de pata genética. Y eso ha revelado que estamos plagados de errores. Cada ser humano es un vasto mosaico de células en su mayoría idénticas, pero diferentes aquí o allá, de una célula o grupo de células a otro.
Los genomas celulares pueden diferir en una sola letra genética en un punto, o en un fragmento más grande de cromosoma perdido en otro. Al llegar a la mediana edad es probable que cada célula del organismo tenga unos mil errores genéticos, estima Michael Lodato, biólogo molecular de la Facultad de Medicina Chan de la Universidad de Massachusetts, en Worcester.
Estas mutaciones —ya sea en la sangre, la piel o el cerebro— se acumulan a pesar de que la maquinaria de copiado del ADN celular es excepcionalmente precisa y de que las células tienen excelentes mecanismos de reparación. Dado que el organismo humano adulto contiene unos 30 billones de células, de las que unos cuatro millones se dividen cada segundo, incluso los errores más raros se acumulan con el tiempo. (Los errores son mucho menos en las células que dan lugar a óvulos y espermatozoides; el organismo parece dedicar más esfuerzo y energía a mantener las mutaciones lejos de los tejidos reproductores para que el ADN prístino se transmita a las generaciones futuras).
“El pequeño milagro es que a todos nos siga yendo tan bien”, dice Jones.
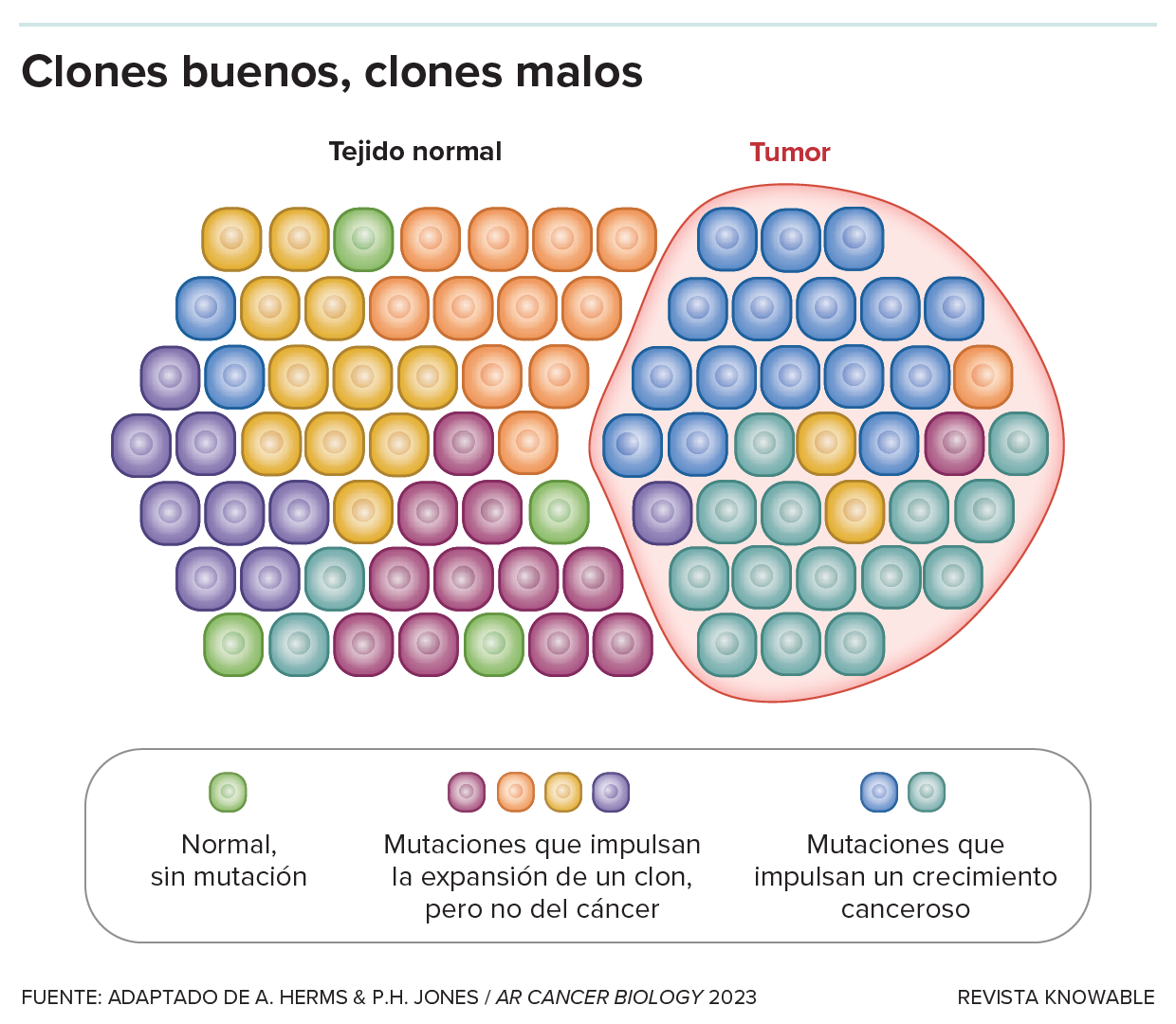
El hecho de que las células que contienen mutaciones se apoderen de un tejido no significa necesariamente que se produzca una enfermedad. Las mutaciones que promueven la expansión de clones pueden ser peligrosas promotoras de cáncer, pero también pueden ser mutaciones neutrales o incluso beneficiosas que mantienen la integridad de un tejido y no promueven el cáncer.
Los científicos aún están en las primeras etapas de investigación sobre las causas y consecuencias de estas mutaciones. Los Institutos Nacionales de Salud están invirtiendo 140 millones de dólares en catalogarlas, además de las decenas de millones gastados por el Instituto Nacional de Salud Mental para estudiar las mutaciones en el cerebro. Aunque muchos cambios probablemente son inofensivos, algunos tienen implicaciones en el desarrollo de cánceres y en enfermedades neurológicas. Y lo que es más importante, algunos investigadores sospechan que los errores genómicos aleatorios de toda una vida podrían ser la base de gran parte del proceso de envejecimiento.
“Sabemos sobre esto hace menos de una década, y es como descubrir un nuevo continente”, dice Jones. “Ni siquiera hemos arañado la superficie de lo que significa todo esto”.
Sospechoso desde el principio
Desde el descubrimiento de la estructura del ADN en los años cincuenta, los científicos habían sospechado que los errores ortográficos genéticos y otras mutaciones que se acumulaban en tejidos no reproductivos o somáticos podían ayudar a explicar las enfermedades y el envejecimiento.
Para los años setenta, los investigadores sabían que las mutaciones que promueven el crecimiento en una fracción de células eran la génesis de los cánceres.
“Se suponía que la frecuencia de este evento era muy, muy baja”, dice Jan Vijg, genetista del Escuela de Medicina Albert Einstein en Nueva York.
Pero era extremadamente difícil detectar y estudiar estas mutaciones. La secuenciación estándar de ADN solo podía analizar grandes cantidades de material genético, extraído de vastos grupos de células, para revelar solo las secuencias más comunes. Las mutaciones raras pasaban bajo el radar. Eso empezó a cambiar alrededor de 2008, dice el biólogo especializado en células madre Siddhartha Jaiswal, de la Universidad de Stanford, en California. Las nuevas técnicas son tan sensibles que se pueden descubrir mutaciones presentes en una fracción minúscula de células —incluso en una sola célula—.
A principios de la década pasada, Jaiswal estaba interesado en cómo podían acumularse las mutaciones en las células sanguíneas de las personas antes de que desarrollaran cánceres de la sangre. A partir de muestras de sangre de más de 17.000 personas, junto a sus colegas descubrieron lo que habían predicho: las mutaciones relacionadas con el cáncer eran raras en personas menores de 40 años, pero ocurrían en mayor cantidad con la edad, representando alrededor del 10 % o más de las células sanguíneas después de cumplir 70 años.
Pero el equipo también vio que las células con mutaciones a menudo eran genéticamente idénticas entre sí: eran clones. La causa, imagina Jaiswal, es que una de los miles de células madre productoras de células sanguíneas del cuerpo adquiere mutaciones que la hacen un poco mejor para crecer y dividirse. Con el paso de las décadas comienza a vencer a las células madre que crecen normalmente, generando un gran grupo de células genéticamente compatibles.
No es sorprendente que estos clones de células sanguíneas mutadas que se dividen eficientemente se vincularan al riesgo de cáncer de la sangre. Pero también se asociaron con un mayor riesgo de enfermedades cardíacas, accidentes cerebrovasculares y muerte por cualquier causa, tal vez porque promueven la inflamación. Y de manera inesperada se asociaron a un riesgo aproximadamente un tercio menor de demencia por alzhéimer. Jaiswal, coautor de un artículo sobre los impactos en la salud de los clones de células sanguíneas publicado en el Annual Review of Medicine de 2023, especula que algunos clones podrían ser mejores en poblar el tejido cerebral o eliminar las proteínas tóxicas.
Mientras Jaiswal y sus colegas buscaban los clones sanguíneos sobre los que reportaron en 2014, los investigadores del Instituto Wellcome Sanger comenzaron a investigar las mutaciones en otros tejidos, empezando por la piel de los párpados. Con la edad, algunas personas desarrollan párpados caídos y se les extirpa quirúrgicamente un poco de piel para solucionarlo. Los investigadores consiguieron estos trozos de cuatro individuos y cortaron círculos de 1 o 2 milímetros de diámetro para hacer la secuenciación genética. “Estuvo lleno de sorpresas”, dice Inigo Martincorena, genetista del Wellcome Sanger. Aunque los pacientes no tenían cáncer de piel, su piel estaba plagada de miles de clones, y entre una quinta y una tercera parte de las células de la piel de los párpados contenían mutaciones relacionadas con el cáncer.
El hallazgo, de que tantas células epiteliales en personas sin cáncer de piel presentaban mutaciones, llamó la atención. “Me quedé asombrado”, afirma James DeGregori, biólogo especializado en cáncer, que trabaja en el Campus Médico Anschutz de la Universidad de Colorado, en Aurora, y que no participó en el estudio.
Los investigadores de Wellcome Sanger identificaron grupos de células idénticas y mutadas en una variedad de tejidos, incluidos el esófago, la vejiga y el colon. Por ejemplo, examinaron las criptas del colon, que son hendiduras en la pared intestinal. Hay unas 10 millones de ellas por persona, cada una habitada por unas 2.000 células, y todas ellas derivadas de un puñado de células madre confinadas a esa cripta. En un estudio de más de 2.000 criptas de 42 personas, los investigadores hallaron cientos de variaciones genéticas en las criptas de personas de 50 años.
Alrededor del 1 % de las criptas normales en ese grupo de edad contenían mutaciones relacionadas con el cáncer, algunas de las cuales pueden suprimir la proliferación de células cercanas, lo que permite que las células mutantes se apoderen de una cripta más rápido. Por sí solo esto no es necesariamente suficiente para generar cáncer colorrectal, pero en raras ocasiones, las células pueden adquirir mutaciones adicionales causantes de cáncer, desbordar los límites de la cripta y generar tumores malignos.
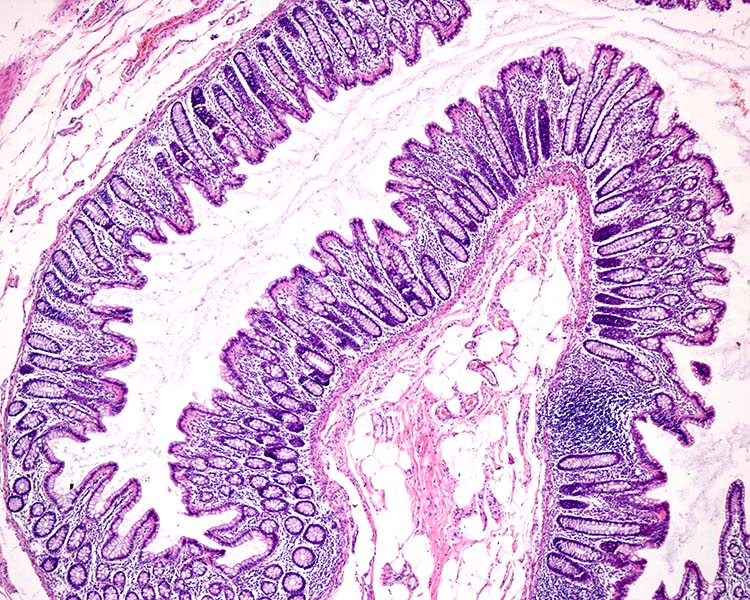
El interior del colon contiene numerosas criptas, o bolsas, cada una de ellas llena de células que derivan de un puñado de células madre confinadas en cada cripta. Estas estructuras hacen del colon un lugar ideal para estudiar la evolución de clones mutantes.
CRÉDITO: JOSLUIS / STOCK.ADOBE.COM
“En todos los lugares donde la gente ha buscado estas mutaciones somáticas, en todos los órganos, las encontramos”, dice Jones. Ha llegado a ver el cuerpo como una especie de campo de batalla evolutivo. A medida que las células acumulan mutaciones pueden volverse más (o menos) capaces de crecer y dividirse. Con el tiempo, algunas células que se reproducen más fácilmente pueden superar a otras y crear clones grandes.
“Y, sin embargo”, señala DeGregori, “no nos llenamos de bultos”. Nuestros tejidos deben tener formas de evitar que los clones se conviertan en cáncer, sugiere. De hecho, en ratones, se ha visto que los clones mutantes que crecen de manera excesiva revierten a un crecimiento normal, como describen Jones y un coautor en el Annual Review of Cancer Biology de 2023.
Jones y sus colegas encontraron un ejemplo de protección en el esófago humano. En la mediana edad, muchos clones de esófago —que a menudo constituyen la mayor parte del tejido esofágico— tienen mutaciones que alteran un gen llamado NOTCH1. Esto no afecta la capacidad del esófago para transportar los alimentos, pero los cánceres parecen necesitar a NOTCH1 para crecer. Las mutaciones dañinas pueden acumularse en las células esofágicas, pero si NOTCH1 está ausente, parece menos probable que se conviertan en tumores.
En otras palabras, algunas de las mutaciones del organismo no son malas ni neutrales, sino que pueden ser beneficiosas. Y, afortunadamente para nosotros, estas mutaciones positivas prevalecen en la mayoría de los casos.
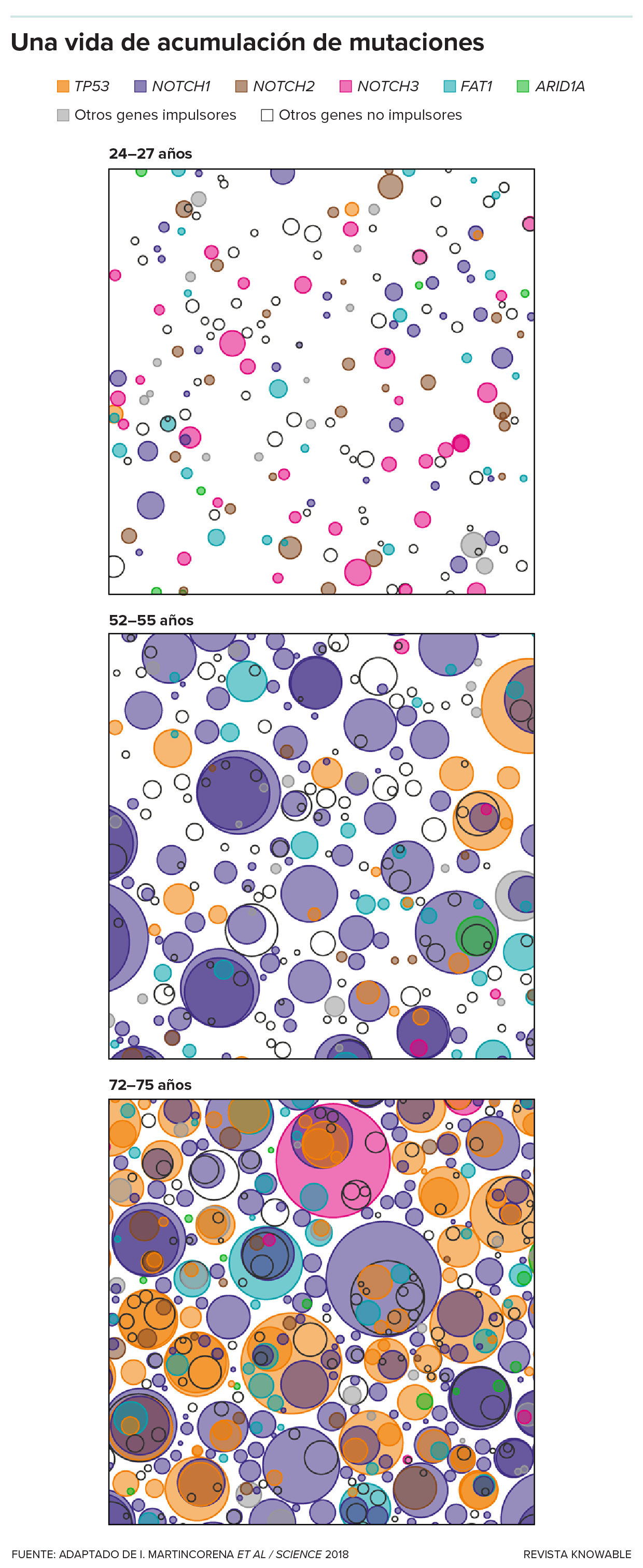
Los clones mutantes aumentan de tamaño a medida que las personas envejecen. En esta imagen, cada panel representa un centímetro cuadrado de tejido del esófago de un sujeto. El sujeto más joven (panel superior) era un fumador moderado; los otros dos eran no fumadores. El tamaño y el color de cada círculo representan un clon con mutaciones en un gen concreto (ver leyenda, arriba). A veces, los clones contienen múltiples mutaciones, representadas por círculos superpuestos. Las mutaciones en algunos genes, como el TP53 (naranja), promueven el cáncer, mientras que las mutaciones en otros genes, como el NOTCH1 (morado), lo suprimen.
Meterse en el cerebro
Nuestra maquinaria de copia del ADN tiene muchas oportunidades de cometer errores en las células del esófago, el colon y la sangre porque se dividen constantemente. Pero las neuronas en el cerebro dejan de dividirse antes o poco después del nacimiento, por lo que los científicos asumieron originalmente que permanecerían genéticamente prístinas, dice Christopher Walsh, neurogenetista del Hospital de Niños de Boston.
Sin embargo, había indicios de que las mutaciones acumuladas a lo largo de la vida podían causar problemas en el cerebro. En 2004, investigadores informaron sobre un paciente que tenía la enfermedad de Alzheimer debido a una mutación presente solo en algunas células cerebrales. La mutación era nueva —no había sido heredada de ninguno de los padres—.
En 2012, el grupo de Walsh informó sobre un análisis de tejido cerebral que se había extirpado durante una cirugía para corregir el crecimiento excesivo del cerebro que estaba causando convulsiones. Tres de las ocho muestras tenían mutaciones que afectaban a un gen que regula el tamaño del cerebro, pero estas mutaciones no estaban presentes de manera constante en la sangre, lo que sugiere que aparecieron solo en una parte del cuerpo.
Hay un par de maneras en que las células cerebrales pueden obtener mutaciones, dice Lodato. Una mutación podría ocurrir en una etapa temprana del desarrollo, antes de que el cerebro estuviera completo y sus células hubieran dejado de dividirse. O, en una célula cerebral madura, el ADN podría ser dañado y no repararse adecuadamente.
Para 2012, el interés por las mutaciones cerebrales no hereditarias estaba en alza. Thomas Insel, director del Instituto Nacional de Salud Mental en ese momento, propuso que este tipo de mutaciones podrían ser la causa de muchas enfermedades psiquiátricas. Las mutaciones no hereditarias en el cerebro podrían explicar un enigma de larga data en las enfermedades neurológicas: por qué los gemelos idénticos a menudo no comparten diagnósticos psiquiátricos (por ejemplo, si uno de ellos desarrolla esquizofrenia, el otro tiene solo un 50 % de probabilidades de padecerla).
El mosaicismo ofrece “una respuesta muy convincente”, dice el neurocientífico Mike McConnell, director científico de la Fundación del Síndrome Lennox-Gastaut, en San Diego, una organización sin fines de lucro que apoya a las familias y la investigación de un tipo grave de epilepsia.
A principios de la década pasada, McConnell, Walsh, Lodato y otros comenzaron a catalogar mutaciones grandes y pequeñas diseminadas en el cerebro de personas que habían muerto. Registraron las deleciones y duplicaciones de genes individuales, de múltiples genes o de cromosomas enteros; detectaron segmentos cromosómicos completos que se habían trasladado a nuevos lugares en el genoma. Y, finalmente, Walsh, Lodato y sus colegas hallaron mil o más mutaciones de una sola letra en el código genético dentro de cada célula nerviosa de personas de unos 50 años. Ese último hallazgo “nos pareció completamente imposible”, recuerda Walsh. “Dudamos de nosotros mismos”.
Ante resultados tan sorprendentes, los científicos investigaron más a fondo. Analizaron 159 neuronas de 15 personas que habían muerto entre los cuatro meses y los 82 años de edad. Informaron que la cantidad de mutaciones aumentaba con la edad, lo que indica que los errores se acumulaban con el tiempo, al igual que en otras partes del cuerpo. “El cerebro es un mosaico, de una manera significativa y profunda”, dice Lodato.
Para explorar más a fondo ese mosaicismo, el Instituto Nacional de Salud Mental financió una serie de proyectos entre 2015 y 2019 que investigaban el mosaicismo del tejido cerebral en muestras, principalmente recolectadas después de la muerte y depositadas en bancos de tejidos, de más de 1.000 personas que eran neurotípicas o tenían afecciones como el síndrome de Tourette y el trastorno del espectro autista.
Las mutaciones de una sola letra fueron las más comunes, afirma McConnell, quien codirigió el proyecto. Los investigadores acumularon más de 400 terabytes de secuencias de ADN y otros datos, y generaron herramientas analíticas, creando una plataforma poderosa sobre la cual construir la siguiente ronda de estudios de mosaicismo cerebral. A partir de ese y otros trabajos, los científicos han vinculado el mosaicismo cerebral con enfermedades neurológicas como el autismo, la epilepsia y la esquizofrenia.
En el laboratorio de Lodato, los estudiantes de posgrado César Bautista Sotelo y Sushmita Nayak ahora están investigando cómo las mutaciones acumuladas pueden causar esclerosis lateral amiotrófica (ELA), una enfermedad paralizante también conocida como enfermedad de Lou Gehrig. Los genetistas pueden identificar una mutación conocida en solo alrededor del 10 % de los casos no hereditarios. Pero los nuevos datos sobre el mosaicismo sugieren que muchas más personas pueden tener mutaciones en los genes de la ELA en el cerebro o la médula espinal, incluso si no las tienen en el resto del cuerpo.
Esto es importante, porque los científicos están trabajando en terapias dirigidas a algunos de los más de 40 genes que, cuando mutan, causan ELA. En 2023, la Administración de Alimentos y Medicamentos de Estados Unidos aprobó el primer tratamiento de este tipo, que desactiva un gen de la ELA comúnmente mutado. Para que los pacientes sean elegibles para estas terapias deberán conocer sus mutaciones.
Por ello, señala Nayak, “somos firmes defensores de un cambio en la práctica actual de diagnóstico de la ELA”. En lugar de observar simplemente el ADN en una muestra de sangre, también se podrían examinar otros tejidos como la saliva, el pelo o la piel, en caso de que una mutación de la ELA surgiera durante el desarrollo de células que no dieron origen a la sangre, pero sí a otros tejidos del cuerpo.
Pistas sobre cómo envejecemos
Por ahora, las repercusiones para la salud del mosaicismo de nuestro cuerpo son, en su mayoría, demasiado confusas como para justificar una acción, en especial en casos como los clones de células sanguíneas, en los que no hay un tratamiento relevante que ofrecer. “Realmente no recomendamos que la gente se preocupe por esto”, dice Jaiswal. “En este momento, no hay ninguna razón para realizar pruebas a personas que están bien”.
Pero muchos científicos ven los hallazgos como evidencia de una teoría de larga data: que toda una vida de mutaciones conduce a la condición inevitable que llamamos envejecimiento.
Martincorena y sus colegas probaron un elemento de esa teoría en un estudio de 2022. Si la acumulación de mutaciones contribuye al envejecimiento, razonaron, entonces las criaturas de vida corta, como los ratones, deberían acumular mutaciones rápidamente, mientras que las especies de vida más larga, como las personas, deberían acumular mutaciones más lentamente, tal vez debido a mejores mecanismos de reparación.
Para investigar esta idea, los científicos se embarcaron en una odisea de cinco años estudiando muestras de criptas de colon de ocho personas y de una colección de criaturas: 19 ratones y ratas de laboratorio; 15 animales domésticos como gatos, perros, vacas y conejos; y 14 animales más exóticos que incluían tigres, lémures, una marsopa común y cuatro ratas topo desnudas, que son famosas por su gran esperanza de vida de más de 30 años. Como se predijo, cuanto más longeva es la especie, más lenta es su acumulación de mutaciones.
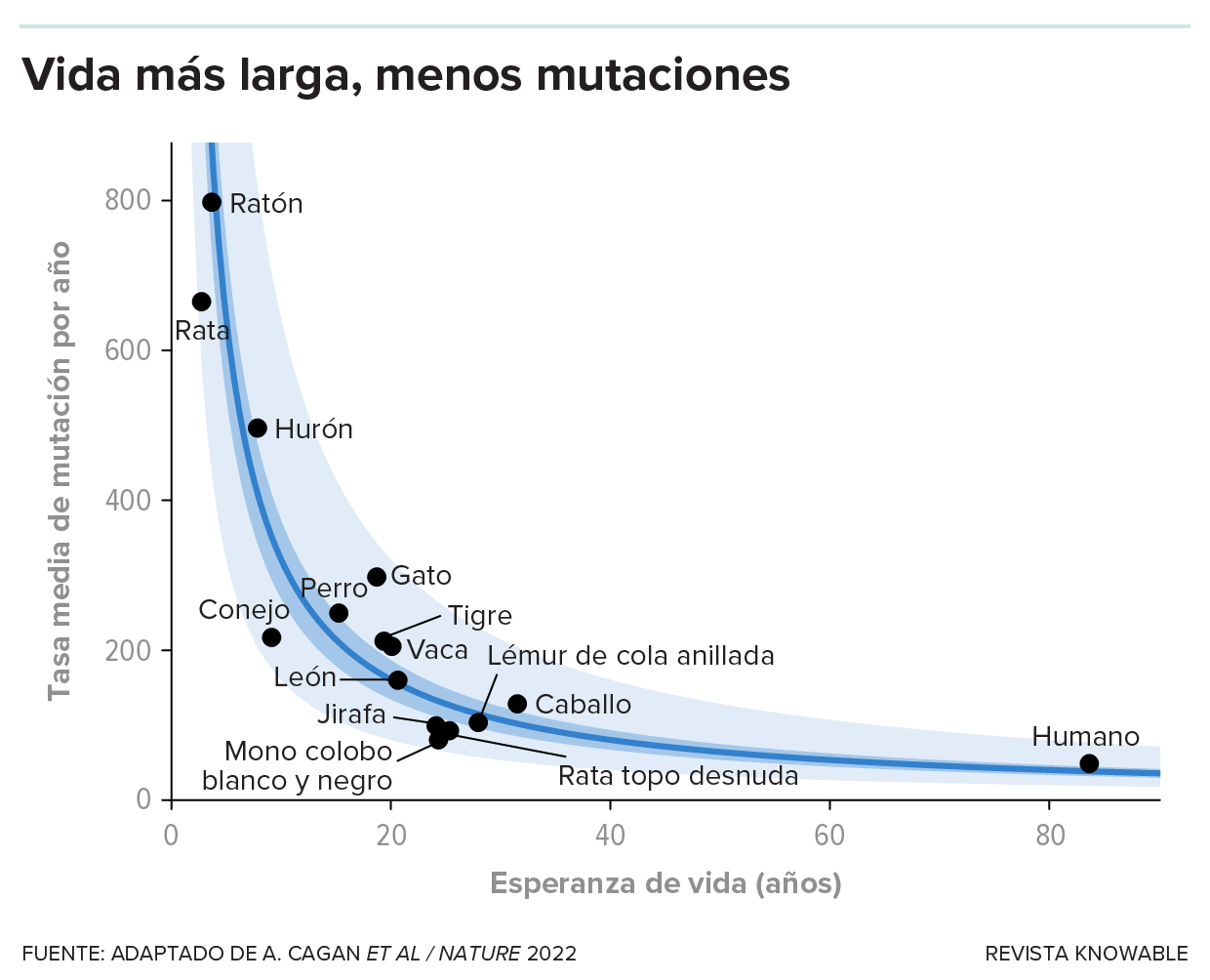
Investigadores analizaron las criptas del colon de varias especies y determinaron que las especies con una vida más larga acumulan mutaciones más lentamente. Esto concuerda con una teoría de larga data que afirma que las mutaciones de las células del cuerpo están relacionadas con el envejecimiento.
“Esto no demuestra que las mutaciones somáticas causen el envejecimiento, pero es coherente con la posibilidad de que desempeñen al menos algún papel”, dice Martincorena. Aquí hay dos factores en juego: la acumulación de mutaciones contribuye a una esperanza de vida más corta, pero luego, un ciclo vital más corto hace que la protección contra las mutaciones sea menos crucial, por lo que las especies de vida corta invierten menos en la reparación del ADN.
La idea de que las mutaciones podrían contribuir al envejecimiento es tentadora, porque sugiere que derrotarlas sería una fuente genética de juventud. “Si mañana descubro una forma de detener la acumulación de estas mutaciones creo que sería multimillonario”, dice Bautista Sotelo. Al menos una empresa de biotecnología emergente, Matter Bio en la ciudad de Nueva York, ya ha recaudado fondos con el objetivo de reparar el genoma humano. (Si un plan de este tipo sería factible en amplias franjas de células es otra cuestión: “No creo que se puedan eliminar las mutaciones”, dice DeGregori.)
La historia de las mutaciones en el cuerpo está lejos de terminar. “A juzgar por los descubrimientos que estamos haciendo ahora, el viaje no ha hecho más que empezar”, afirma Martincorena. “Espero muchas sorpresas en los próximos años”.
Artículo traducido por Daniela Hirschfeld
10.1146/knowable-022025-1
Apoye a la revista Knowable
Ayúdenos a hacer que el conocimiento científico sea accesible para todos
DONAREXPLORE MÁS | Lea artículos científicos relacionados