Finalmente estableciendo el vínculo entre genes y enfermedades cardíacas
Las puntuaciones de riesgo poligénico —la probabilidad de que un paciente desarrolle enfermedades cardiovasculares, cáncer de mama, entre otras condiciones, basada en pequeñas variantes genéticas— están llegando al consultorio médico. No obstante, aún quedan cosas por pulir y la precisión sigue siendo un problema.
Manténgase informado
Suscríbase al boletín de noticias de Knowable en español
¿Cuáles son sus probabilidades de sufrir un ataque cardíaco en la próxima década? Si supiera eso, podría orientar la toma decisiones vinculadas a su salud y estilo de vida. Su médico podría incorporar factores como edad, niveles de colesterol y presión arterial en una ecuación que resulte en un nivel de riesgo estimado para los próximos 10 años: ¿alto?, ¿bajo?, ¿en algún punto intermedio? Si el riesgo es alto, su doctor puede recomendarle cambios: opte por una dieta más sana, haga más ejercicios, etc.
Pero estas predicciones están lejos de ser perfectas. Los estudios sugieren que la mayoría de estos cálculos tienden a sobreestimar el riesgo, hasta en un 154 %, y también pueden subestimarlo. Esto se debe, en parte, a que a estas estimaciones les faltan muchos datos relevantes. Fundamentalmente, en esta era genética moderna, dejan de lado factores genéticos conocidos, pero poco comprendidos, que son responsables de alrededor de la mitad del riesgo de una persona de desarrollar una enfermedad cardiovascular.
Puede sonar sorprendente que no hayamos avanzado en el uso de genes para predecir cuestiones de salud. Después de todo, han pasado más de 20 años desde la publicación en 2003 de la primera secuencia del genoma humano. Se esperaba que ese caudal de datos marcara el inicio de una nueva era en la que genes clave predecirían el riesgo y permitirían personalizar las recomendaciones médicas. Incluso antes de la secuenciación del genoma humano, por ejemplo, ya sabíamos que tener una variante genética asociada a la enfermedad de Huntington significaba que la condición neurológica eventualmente surgiría. Y sabíamos que las mutaciones en los dos genes BRCA aumentaban el riesgo de cáncer de mama de manera tan significativa que algunas mujeres optan por protegerse con mastectomías preventivas.
Pero aquí está el problema: ese tipo de genes de gran impacto son pocos e infrecuentes. Y para sorpresa de quienes secuencian el genoma, solo 2 % del genoma codifica proteínas, mientras que muchas variantes relacionadas con enfermedades se encuentran en el otro 98 %, alguna vez llamado “ADN basura”. Los científicos ahora saben que gran parte de ese ADN está lejos de ser basura, y ayuda a controlar cómo las células utilizan los genes que codifican proteínas. Saben también que gran parte del riesgo de trastornos, como el cáncer y las enfermedades cardíacas, resulta de mínimas variaciones en muchas letras genéticas remotas, cada una con impactos minúsculos individualmente. Algunas de las variaciones podrían proteger un poco contra una enfermedad; otras podrían hacerlo un poquito más susceptible. Si los médicos pudieran sumar todos esos pequeños factores, todos esos pros y contras, podrían ofrecer estimaciones mucho mejores del riesgo de enfermedad. Aun así, ha sido tremendamente difícil descubrir todas las asociaciones.
Actualmente, el valor neto de esos pequeños influyentes genéticos, llamado puntuación de riesgo poligénico, se acerca al uso clínico. El tema ha avanzado más para las enfermedades cardiovasculares, y los predictores del cáncer de mama también están incorporando variantes con efectos pequeños, mientras se evalúa la utilidad de las puntuaciones de riesgo para otros cánceres. Asimismo, a través de una red de sitios de investigación se están analizando las puntuaciones de riesgo poligénico para trastornos como asma, obesidad y diabetes. Fuera del sector de atención médica estándar, empresas como 23andMe ya ofrecen a sus clientes de pago una serie de puntuaciones de riesgo y consejos de salud asociados.
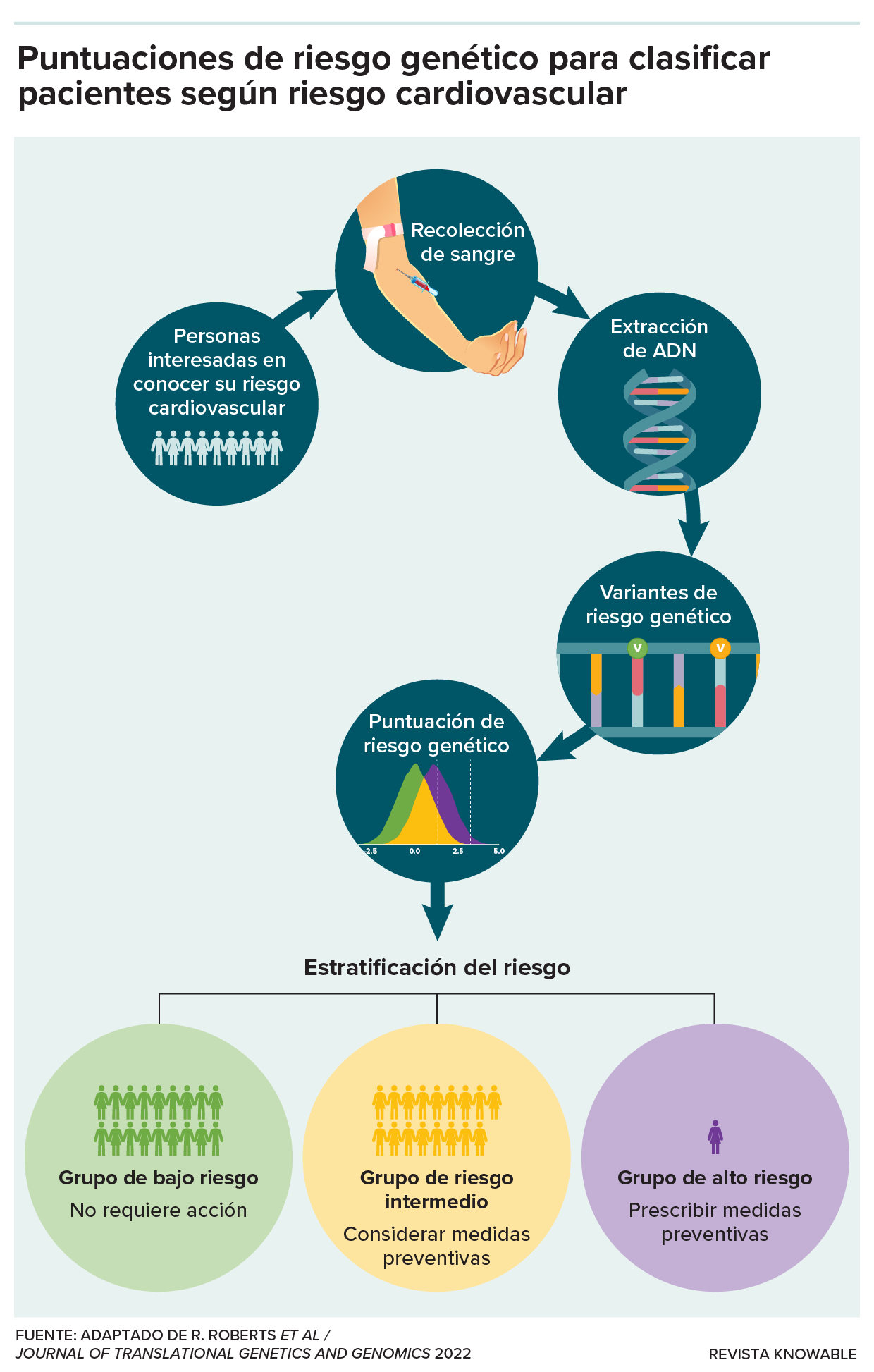
He aquí cómo pueden utilizarse en un entorno médico las puntuaciones de riesgo poligénico de enfermedad cardiovascular. A las personas interesadas en saber cómo sus genes afectan su riesgo de padecer enfermedades cardiovasculares se les extrae una muestra de sangre. Los científicos extraen el ADN de la sangre e identifican las variantes del genoma asociadas a un mayor o menor riesgo. A partir de todas esas variantes, pueden calcular una puntuación de riesgo poligénico. Las personas de bajo riesgo probablemente no requieran más atención. A las personas con riesgo alto probablemente se les prescriban intervenciones, como estatinas. Las personas en el grupo intermedio podrían considerar medidas de protección, como cambios en la dieta.
Todavía quedan obstáculos importantes. Para muchas enfermedades, los científicos necesitan más datos para identificar todos los genes relevantes con pequeños efectos. E incluso en casos como las enfermedades cardíacas, donde la lista de genes es relativamente completa, las puntuaciones de riesgo pueden resultar confusas —tanto para los pacientes como para los proveedores de atención sanitaria—. Para integrar ampliamente las puntuaciones en la práctica médica, los científicos deben encontrar cómo comunicar el riesgo de forma efectiva y precisa, y cómo aplicar la información para mejorar las perspectivas de salud de una persona.
Otro problema importante es que la mayoría de los estudios del genoma se han realizado en personas de ascendencia europea, lo que da como resultado puntuaciones de riesgo menos precisas para otras etnias. Los científicos ahora buscan recopilar más datos genéticos para mejorar las puntuaciones de riesgo poligénico para individuos de ascendencia variada.
“No es apropiado implementarlos solo para una etnia, o aplicarlos a todas las etnias sabiendo que no funciona bien, por lo que esto es realmente una cuestión de justicia”, dice Russ Altman, genetista computacional de la Universidad de Stanford, en California.
Por lo tanto, para la mayoría de las afecciones de salud, crear puntuaciones reproducibles de grado clínico, en las que los médicos confíen y puedan adoptar, requerirá más trabajo, dicen los investigadores —y ese trabajo aún está en proceso—.
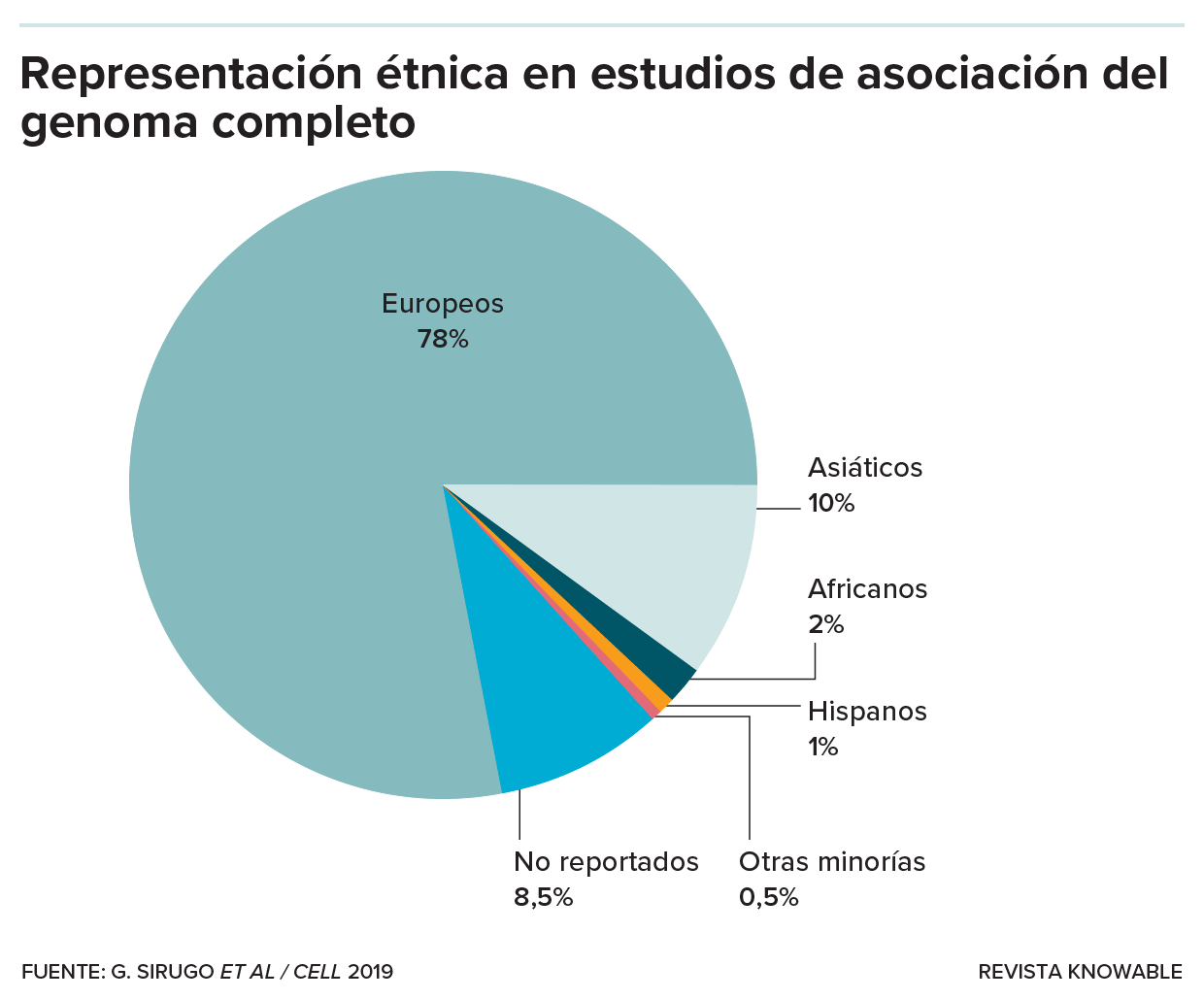
Los estudios de asociación del genoma completo (GWAS, por sus siglas en inglés) se utilizan para crear los algoritmos de las puntuaciones de riesgo poligénico. Pero se basan en un conjunto de sujetos mayoritariamente europeos, a pesar de que los europeos solo representan alrededor del 16 % de la población mundial.
Más allá del prototipo de las arvejas
Las puntuaciones de riesgo poligénico se basan en una genética diferente de la que muchos de nosotros aprendimos en la escuela secundaria. Para el monje Gregor Mendel y sus plantas de arvejas o guisantes, un solo gen controlaba el color del guisante: una variante del gen lo hacía verde, otra lo hacía amarillo, y así sucesivamente para otros rasgos de los guisantes que estudió. Algunas enfermedades humanas funcionan de la misma manera: la anemia falciforme, por ejemplo, la fibrosis quística o la hemofilia son el resultado de mutaciones de un solo gen.
Pero muchos rasgos y condiciones comunes tienen un patrón de herencia mucho más complejo. Para cuestiones como la altura, la salud cardiovascular y muchos tipos de cáncer, la lotería genética no depende de uno o de unos pocos genes todopoderosos, sino de miles, incluso cientos de miles, de pequeñas variaciones en el ADN de una persona. Una variación podría ser un único cambio en una letra genética, una A sustituida por una T, por ejemplo. O podría ser una pequeña inserción o eliminación en esa cadena de letras del ADN. Un cambio podría aumentar el riesgo de enfermedad en, digamos, un 0,001 %. Otro podría reducirlo en un 0,005 %. Y así sucesivamente. Las puntuaciones de riesgo poligénico son algoritmos que resumen todos esos pequeños factores.
Los científicos encuentran correlaciones entre variaciones genéticas y enfermedades a través de lo que se llaman estudios de asociación del genoma completo, que examinan los genomas de cientos o miles de personas, junto con sus historiales médicos, y luego observan si una variación genética determinada tiende a coincidir con una condición de salud. Ahora, después de dos décadas de este tipo de estudios, los científicos saben mucho —y finalmente pueden comenzar a calcular las puntuaciones poligénicas—.
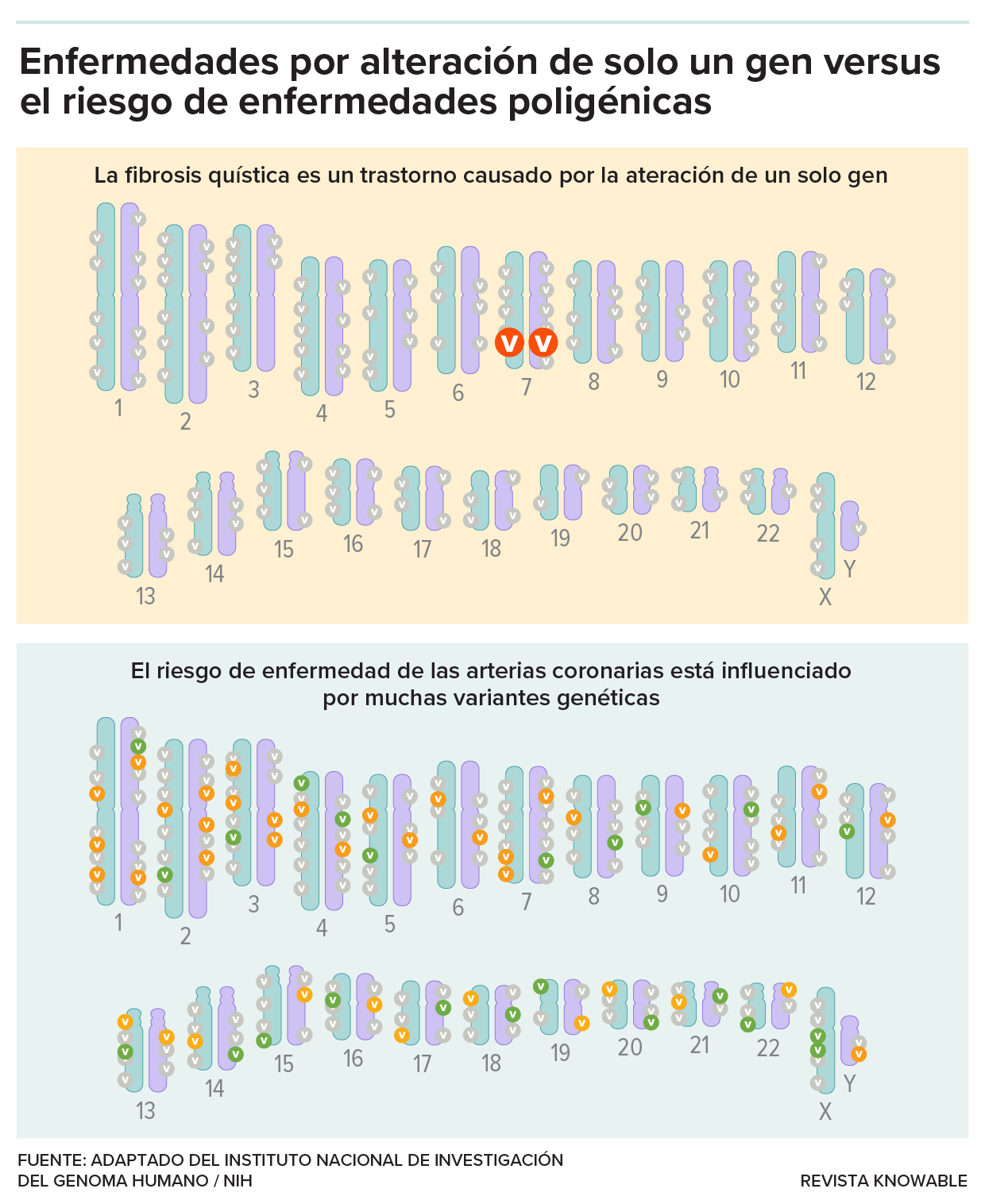
El genoma de nadie es exactamente igual al de otro, y algunas variantes genéticas causan una enfermedad o aumentan el riesgo de desarrollar una. En el caso de los trastornos monogenéticos (arriba), como la fibrosis quística, basta una variante en un solo gen para causar la enfermedad. En el caso de los trastornos poligénicos (abajo), es más complicado. Hay muchas variantes genéticas implicadas, cada una con pequeños efectos. Algunas variantes (verde) protegen un poco, mientras que otras (naranja) aumentan un poco el riesgo general. Las puntuaciones de riesgo poligénico son los valores netos de todas esas variantes.
Hay una advertencia en los estudios de asociación del genoma completo: solo por el hecho de que una variante tienda a correlacionarse con una enfermedad no significa necesariamente que la variante cause la enfermedad. “Solo son etiquetas”, dice Alicia Martin, experta en genética humana del Instituto Broad, del Instituto Tecnológico de Massachusetts (MIT) y de la Universidad de Harvard, y del Hospital General de Massachusetts. La etiqueta podría simplemente estar ubicada en un cromosoma cerca del culpable real del aumento de riesgo, de modo que tienden a heredarse juntos. Pero en el caso de las puntuaciones de riesgo poligénico, esto no importa. Todo lo que necesitan saber los investigadores es que la presencia de esa etiqueta significa que el riesgo de desarrollar la enfermedad aumenta o disminuye.
Los investigadores subrayan que las puntuaciones de riesgo poligénico no son un destino genético inevitable como lo es, por ejemplo, el gen de la enfermedad de Huntington o el de la anemia falciforme. El riesgo es generalmente modificable. Si el riesgo genético de una persona de sufrir una enfermedad cardíaca es alto, podría hacer ejercicio y alimentarse bien y muy probablemente reducir su riesgo general. Por el contrario, un riesgo genético bajo no debe tomarse como una licencia para comer tocino en cada comida: las malas decisiones de salud aún podrían poner en riesgo al corazón.
La promesa de las puntuaciones de riesgo poligénico es identificar a las personas que tienen alto riesgo para que puedan tomar medidas para protegerse o hacerse exámenes regulares de tamizaje, dice Bertram Koelsch, ingeniero biomédico y director de investigación y desarrollo de productos en 23andMe, en Sunnyvale, California. Los informes de la compañía incluyen casi 40 puntuaciones de riesgo diferentes para afecciones que incluyen al melanoma, la diabetes gestacional y las migrañas.
Algunas empresas incluso afirman que usan puntuaciones de riesgo poligénico para detectar embriones en parejas que planifican embarazos, aunque muchos expertos dicen que no es apropiado hacerlo.
Aun así, estos puntajes comerciales son una “caja negra” porque sus algoritmos son propiedad de la empresa y a menudo no está claro en qué poblaciones fueron evaluados y validados, dice Aniruddh Patel, cardiólogo del Hospital General de Massachusetts. (Koelsch dice que 23andMe entrena y prueba sus puntajes en personas de diversos orígenes). Decirle a alguien si se encuentra en el quintil más alto o más bajo de personas en riesgo de sufrir problemas cardíacos podría ser útil, y el consejo —por ejemplo, dejar de fumar— no hará daño a nadie, dice Alexander Hatoum, genetista del comportamiento de la Universidad de Washington en San Luis. Pero, añade, “la mayoría de los trastornos no están listos”.
Para que las puntuaciones de riesgo poligénico alcancen un uso generalizado, los médicos necesitarán capacitación específica y pautas oficiales que les indiquen cómo asesorar a los pacientes sobre sus puntuaciones, dice Patel. Un cardiólogo como él, por ejemplo, querría una orientación clara de la Asociación Estadounidense del Corazón o del Colegio Estadounidense de Cardiología.
Hacer que los informes de puntuación de riesgo sean comprensibles para los médicos y los pacientes no es simple. Por ejemplo, en un estudio de 2022 investigadores del Hospital General de Massachusetts probaron informes simulados de puntuación de riesgo poligénico con 25 personas que actuaban como “pacientes” y 21 proveedores de atención primaria. Muchos pacientes no entendían lo que significaban los números. Por ejemplo, cuando se les dijo que estaban en el percentil 95 de riesgo, lo que significa que su riesgo era superior al 95 % de las personas, muchos lo interpretaron en el sentido de que su riesgo absoluto de desarrollar la enfermedad era del 95 %. Incluso dos proveedores de atención primaria cometieron este error.
También es importante considerar el riesgo promedio de sufrir una afección, dice Martin. Tomemos como ejemplo el cáncer de tiroides: hay alrededor de 43.720 casos nuevos en Estados Unidos cada año, que afectan al 1,2 % de las personas a lo largo de su vida. Incluso si las variantes del ADN duplican o triplican el riesgo de una persona, sigue siendo un riesgo pequeño.
Son muchos matices para asimilar en una cita con el médico.
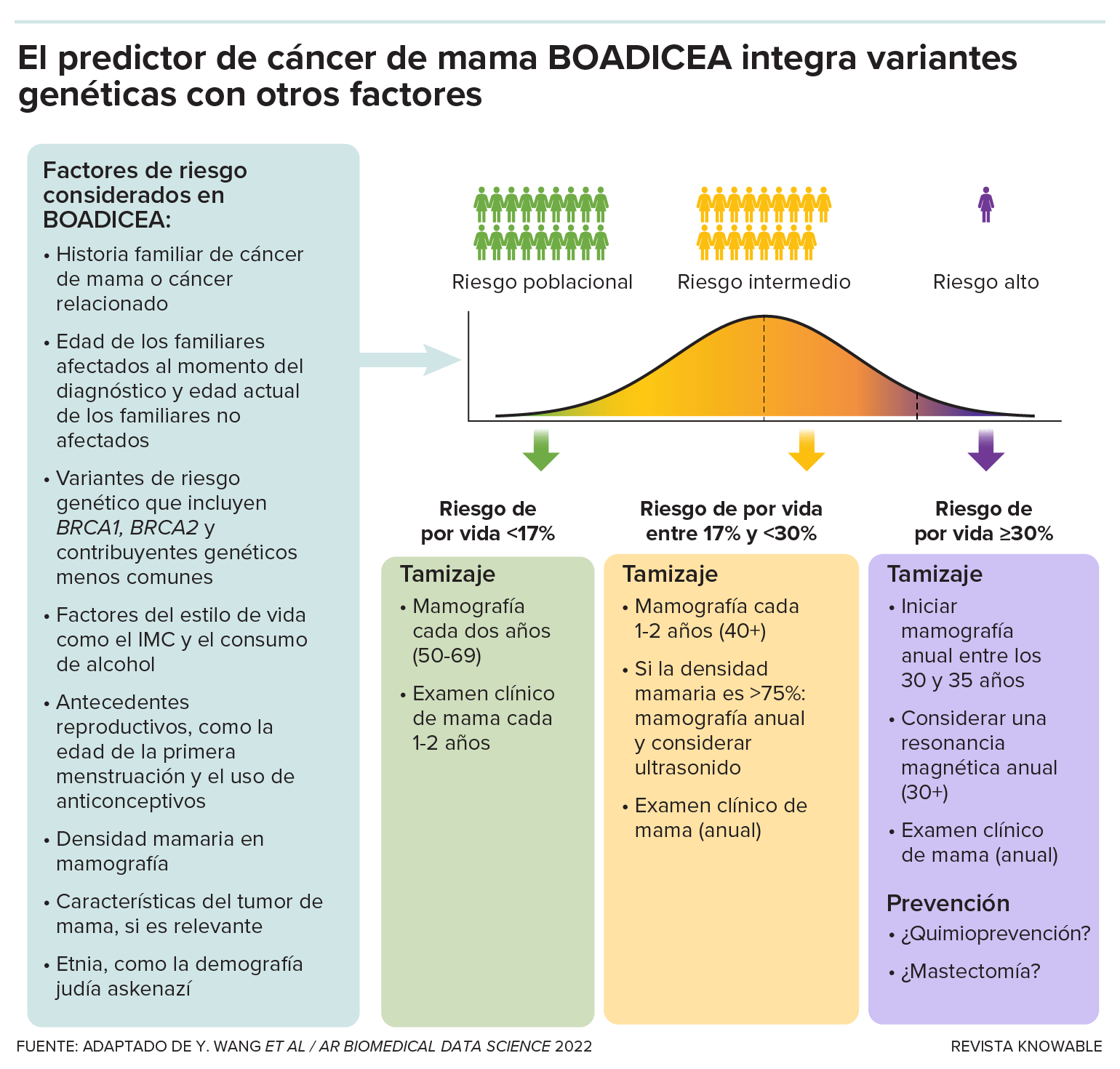
El algoritmo de predicción del cáncer de mama BOADICEA incorpora una variedad de factores, incluidos variantes genéticas, para calcular el riesgo de cáncer de mama a lo largo de la vida de una persona. La mayoría terminará con un riesgo de por vida que es bajo (en el 17 % inferior de la población) o intermedio (entre el 17 % y el 30 % de la población). Cuanto mayor sea el riesgo calculado, más medidas preventivas y de detección temprana se recomiendan.
Más allá del asesoramiento adecuado, también está el costo. Identificar las variantes en el genoma de un individuo puede costar tan solo 40 dólares, dice Patel, pero la interpretación experta o la capacitación médica requerirá dinero, al igual que instalar servidores seguros para almacenar una gran cantidad de datos genéticos —alrededor de 100 gigabytes por genoma—. “Para que llegue a una clínica cercana, las compañías de seguros tienen que aceptarlo”, dice Patel, quien escribió sobre las puntuaciones de riesgo poligénico para la enfermedad de las arterias coronarias en el Annual Review of Medicine de 2023. Por lo tanto, los científicos deben demostrar que las puntuaciones de riesgo valen la inversión.
En particular, las enfermedades cardiovasculares están acercándose a eso.
En un estudio de 2021, por ejemplo, investigadores del Reino Unido usaron datos del UK Biobank, un enorme repositorio de información genética y sanitaria de medio millón de participantes, para comprobar si las puntuaciones de riesgo poligénico aportan valor agregado. Lo que hallaron fue que cuanto mayor era la puntuación de riesgo poligénico, más probable era, en efecto, que una persona hubiera desarrollado una enfermedad coronaria o sufriera un derrame cerebral.
En otra parte de ese estudio los investigadores estimaron cuánto mejores serían las puntuaciones de riesgo poligénico para guiar un tratamiento en comparación con las evaluaciones de riesgo estándar. Primero, crearon una población hipotética de 100.000 personas de entre 40 y 75 años, con las características de edad, sexo y enfermedades cardiovasculares de la población general del Reino Unido. Luego imaginaron que a todas las personas que obtuvieron una puntuación de riesgo de enfermedad cardiovascular alta o media basada en factores estándar también se les había hecho una puntuación de riesgo poligénico. Por último, en esas personas asumieron que todos aquellos cuya genética indicara un alto riesgo serían tratados con estatinas para reducir el colesterol.
El resultado: los cálculos del equipo mostraron que más personas serían identificadas como de alto riesgo y recibirían estatinas, y esto podría prevenir un 7 % más de ataques cardíacos que las pruebas de detección estándar por sí solas. Esto supondía salvar muchas vidas.
En busca de más no-europeos
A pesar de este potencial, las puntuaciones de riesgo poligénico aún tienen un gran problema: funcionan mejor para personas de ascendencia europea, como describieron Martin y sus colegas en el Annual Review of Biomedical Data Science. Los europeos constituyen alrededor del 16 % de la población mundial, pero son casi el 80 % de los participantes en estudios de asociación del genoma completo. Eso significa que las variantes genéticas que los europeos tienen tienden a poseer una enorme influencia en los algoritmos de puntuación de riesgo poligénico.
Pero las etiquetas genéticas que señalan una enfermedad en personas de ascendencia europea podrían no funcionar de la misma manera en personas de diferentes ascendencias. Esto se remonta a la evolución de la humanidad: si bien el Homo sapiens surgió en África, con el tiempo, diferentes poblaciones desarrollaron distintos conjuntos de pequeñas variantes particulares para cada grupo. Las etiquetas genéticas que existen en las personas de ascendencia europea podrían no existir en otros grupos —o podrían estar presentes, pero sin los mismos vínculos con enfermedades—.
Por ejemplo, en un estudio de 2021 sobre una puntuación de riesgo poligénico para cuestiones relacionadas con el corazón, como la diabetes o la presión arterial, los investigadores hallaron que las puntuaciones eran cinco veces más precisas para los estadounidenses de origen europeo que para los afroamericanos, y 20 veces mejores para los estadounidenses de origen europeo que para los africanos subsaharianos.
El hecho de que las personas de ascendencia no europea probablemente obtengan resultados menos precisos en una puntuación de riesgo poligénico significa que si quienes diseñan las puntuaciones no son cuidadosos, sus resultados podrían exacerbar las disparidades de salud existentes, afirma Ryan Bogdan, investigador en psicología de la Universidad de Washington, en San Luis.
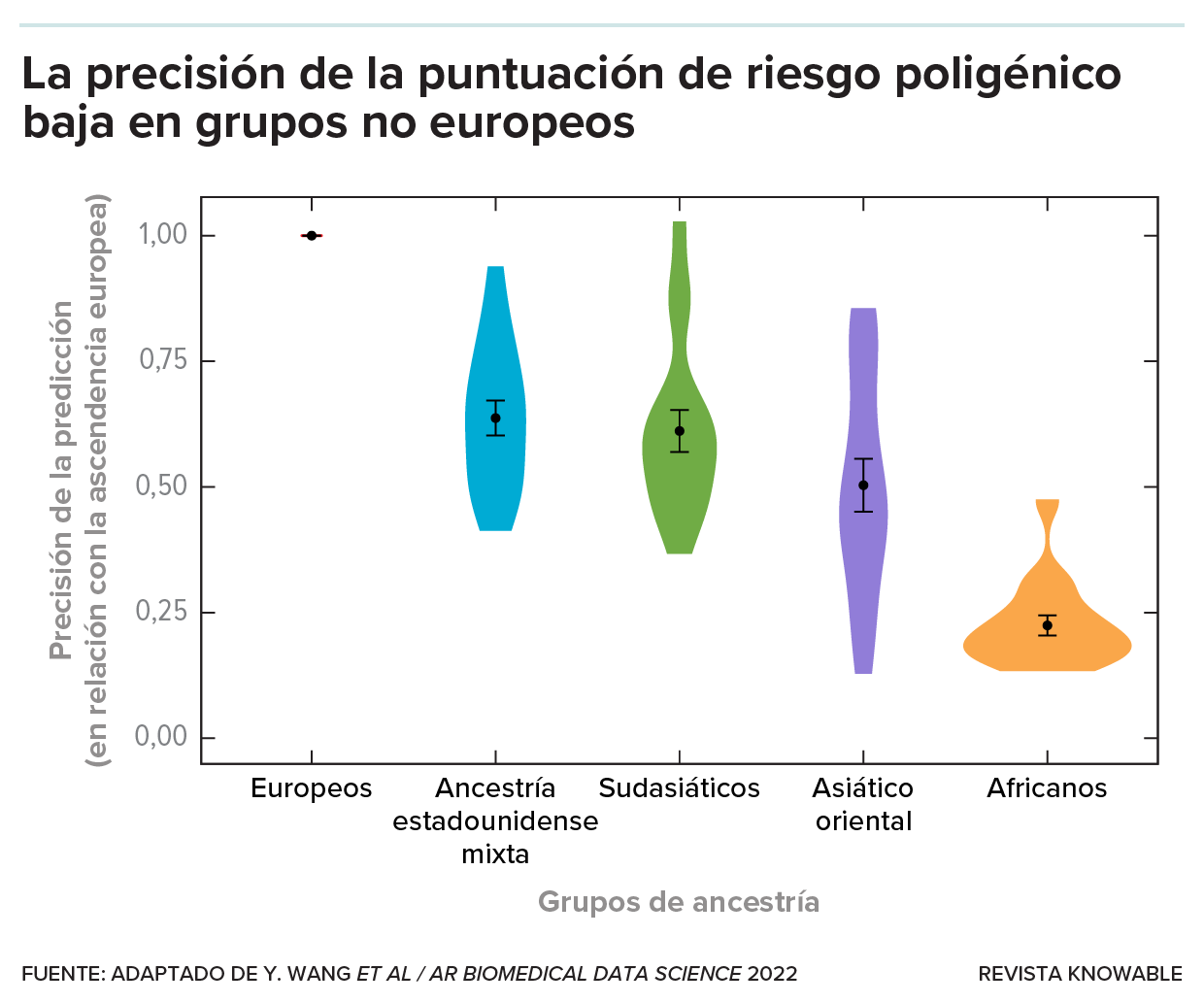
Este gráfico muestra qué tan bien funcionan las puntuaciones de riesgo poligénico para diferentes grupos demográficos, todo en comparación con el desempeño de las puntuaciones en europeos. Por tanto, la interpretación para los europeos es 1. Las formas son diagramas de violín que representan la distribución del desempeño de las puntuaciones para cada grupo étnico. Las puntuaciones de riesgo poligénico para todos los grupos no europeos son menos precisas que para los europeos.
En teoría, la solución es sencilla, pero difícil de poner en práctica: reclutar personas más diversas para los estudios de asociación del genoma completo que sustenten a las puntuaciones de riesgo poligénico. “Ahora el gran impulso es tratar de conseguir cohortes con mayor diversidad de ancestralidad”, dice Bogdan.
En un informe de 2023, Patel y sus colegas hicieron precisamente eso: incorporaron datos del genoma completo de cinco ancestrías diferentes en una nueva puntuación de riesgo poligénico para la enfermedad de las arterias coronarias. Así descubrieron que el nuevo puntaje funcionaba mejor para personas de ascendencia hispana, asiática y africana. También funcionó mejor para los europeos. Esto se debe a que puede haber variantes genéticas relacionadas con el riesgo que son raras en los europeos u otras etnias, pero que es más probable que se encuentren en personas de ascendencia africana más reciente. Cuanto más completos sean los datos que alimentan las puntuaciones de riesgo poligénico, más precisas serán las puntuaciones que se obtengan —para todos—.
Varias iniciativas están trabajando para mejorar la diversidad genética. África, en especial, es el mejor lugar para buscar, porque sus habitantes tienen la mayor diversidad genética. “Cuando investigas en África, investigas toda la humanidad”, dice Ananyo Choudhury, bioinformático de la Universidad de Witwatersrand, en Johannesburgo, Sudáfrica.
Sin embargo, los desafíos de construir en África la infraestructura para realizar estudios genéticos generalizados allí han hecho difícil cumplir con la promesa genética del continente. H3Africa, un proyecto de 10 años y 176 millones de dólares que busca variantes genéticas relacionadas con enfermedades, concluyó en 2022 con datos genéticos de 50.000 participantes. Es una cifra insignificante en comparación con los estudios de asociación del genoma completo realizados en otros lugares, afirma Choudhury.
Pero el trabajo continúa. Por ejemplo, el Meharry Medical College, de Nashville, Tennessee, anunció recientemente un proyecto a cinco años para recolectar ADN de al menos 500.000 personas de ascendencia africana, tanto en Estados Unidos como en África. Y el programa de investigación estadounidense “All of US” tiene como meta recopilar información genética de al menos un millón de individuos diversos. En los primeros cinco años del proyecto se han acumulado datos genéticos de más de 312.000 personas. Esto debería ser suficiente para mejorar las puntuaciones de riesgo para enfermedades comunes en personas de varias etnias, señala Julia Moore Vogel, directora principal de programas del proyecto del Centro de Participantes en Scripps Research en La Jolla, California.
Con una inversión adicional en investigación, las puntuaciones de riesgo poligénico podrían algún día cumplir lo que prometía el genoma humano: lograr recomendaciones personalizadas incluso para afecciones multifactoriales comunes en personas de cualquier ascendencia y, por lo tanto, dar oportunidades a todos de estar tan saludables como lo permita su ADN individual.
Todos los obstáculos no han disminuido el entusiasmo de los científicos por el enorme potencial del análisis de riesgos poligénicos. Estén atentos: este campo, dice Martin, “está evolucionando extremadamente rápido”.
Artículo traducido por Daniela Hirschfeld
10.1146/knowable-030524-1
Apoye a la revista Knowable
Ayúdenos a hacer que el conocimiento científico sea accesible para todos
DONAREXPLORE MÁS | Lea artículos científicos relacionados